时间:2020-08-13 05:43:04
1、填空题 (4分)物质的量浓度相同的 ① 氨水 ② 氯化铵 ③ 碳酸氢铵 ④ 硫酸氢铵 ⑤ 硫酸铵五种溶液中c(NH4+)大小的顺序是__________________,溶液pH大小的顺序是__________________。
参考答案:⑤④②③①, ①③②⑤④
本题解析:1摩尔硫酸铵能电离出2摩尔铵根离子,所以铵根离子浓度最大,1摩尔硫酸氢铵和碳酸氢铵,氯化铵都能电离出1摩尔铵根离子,在硫酸氢铵中氢离子存在抑制铵根离子水解,碳酸氢根促进铵根水解,所以硫酸氢铵中铵根浓度大于氯化铵大于碳酸氢铵,氨水是弱碱,不能完全电离,所以铵根离子浓度最小。氨水显碱性,碳酸氢铵中双水解,溶液显碱性,硫酸铵中铵根多于氯化铵,水解的铵根离子多,酸性强些,硫酸氢铵电离出氢离子,溶液显酸性,所以pH最小,所以pH的顺序为①③②⑤④
考点:溶液中的离子浓度和pH的比较,
本题难度:一般
2、选择题 现有1.0 mol/L的NaOH溶液0.1L,若通入标准状况下体积为2.24L 的SO2气体,使其充分反应后,则所得溶液中各粒子浓度大小关系正确的是
A.c(Na+)+c(H+) = c(HSO3
参考答案:
本题解析:
本题难度:困难
3、选择题 下列用来表示物质变化的化学用语中,正确的是
A.钢铁发生电化学腐蚀的正极反应式: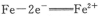
B.HS-的水解方程式:
C.CO32-的水解方程式:
D.AlCl3溶液与Na2CO3溶液混合:
参考答案:C
本题解析:A、钢铁发生腐蚀时负极是铁失去电子变成亚铁离子,正极是氧气反应,所以不选A;B、硫氢根离子水解生成硫化氢,所以不选B;C、碳酸根离子水解要分步,第一步水解生成碳酸氢根离子和氢氧根离子,所以选C;D、铝离子和碳酸根离子双水解生成氢氧化铝和二氧化碳,不选D。
考点:离子方程式的判断,盐类的水解。
本题难度:一般
4、选择题 加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该固体物质的是
A.氯化铝
B.碳酸氢镁
C.碳酸钠
D.高锰酸钾
参考答案:C
本题解析:A.氯化铝在加热过程中促进水解,生成的氯化氢挥发,得到氢氧化铝,再加热得到氧化铝固体,故A错误;B.碳酸氢镁在加热过程中分解,故B错误;C.碳酸钠在加热蒸干过程中没有变化,故C正确;D.高锰酸钾加热时会分解,故D错误。
考点:盐类水解的应用
本题难度:一般
5、填空题 (16分)物质在水中可能存在电离平衡、盐的水解平衡等,它们都可看作化学平衡。请根据所学的知识回答:
(1)0.01mol/L的NH4Cl溶液中各种离子的浓度由大到小顺序为 ;电荷守恒关系: ;浓度为0.01mol/L的是 ; 和 两种粒子的浓度之和是0.01mol/L。
(2 )CH3COONa溶液中存在的2个平衡体系分别为(分别用离子方程式表示): 、 ;
(3) FeCl3溶液与Na2CO3溶液混合后,反应的离子方程式为 .
参考答案: (1)c(Cl-)>c(NH4+)>c(H+)>c(OH-) , c(H+)+ c(NH4+)= c(Cl-)+ c(OH-) , Cl-, NH4+ NH3.H2O
(2)CH3COO-+H2O CH3COOH+OH-, H2O
CH3COOH+OH-, H2O H++OH-
H++OH-
(3)2Fe3++3CO32-=2Fe(OH)3↓+3CO2↑
本题解析:(1)氯化铵水解显酸性,但水解程度还是很弱的,所以离子的浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-)。满足电荷守恒的关系是c(H+)+ c(NH4+)= c(Cl-)+ c(OH-)。根据氮原子守恒可知NH4+和NH3.H2O两种粒子的浓度之和是0.01mol/L。因为氯离子不水解,所以氯离子的浓度也是0.01mol.L的。
(2)水溶液中一定有水的电离平衡。醋酸钠水解显碱性,所以还存在水解平衡。
(3)氯化铁水解显酸性,碳酸钠水解显碱性,所以二者的混合液水解相互促进,使水解完全,生成氢氧化铁沉淀,放出CO2气体。
本题难度:困难