时间:2020-08-13 05:11:19
1、填空题 (11分)在常温下,下列五种溶液:
①0.1mol/L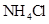 ②0.1mol/L
②0.1mol/L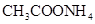 ③0.1mol/L
③0.1mol/L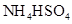
④0.1mol/L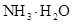 和0.1mol/L
和0.1mol/L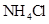 混合液 ⑤0.1mol/L
混合液 ⑤0.1mol/L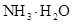
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)
____________________________________________________________________________。
(2)在上述五种溶液中,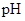 最小的是 ;
最小的是 ; 最小的是 (填序号)
最小的是 (填序号)
(3)比较溶液②、③中 的大小关系是② ③(填“>”、“<”或“=”)。
的大小关系是② ③(填“>”、“<”或“=”)。
(4)在溶液④中, 离子的浓度为0.1mol/L;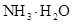 和 离子的物质的量浓度之和为0.2mol/L。
和 离子的物质的量浓度之和为0.2mol/L。
(5)常温下,测得溶液②的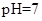 ,则说明
,则说明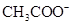 的水解程度 (填“>”、“<”或“="”" )
的水解程度 (填“>”、“<”或“="”" )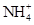 的水解程度,
的水解程度,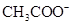 与
与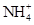 浓度的大小关系是:
浓度的大小关系是: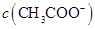
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
2、选择题 向水中加入下列物质,其中能使水的电离程度增大的物质是
A.NaCl
B.NH4Cl
C.HCl
D.NaOH
3、选择题 下列电离方程式不正确的是( )
A.H2SO4=2H++SO42-
B.NH4NO3=NH4++NO3-
C.Na2CO3=Na2++CO32-
D.Ba(OH)2=Ba2++2OH-
4、选择题 下列溶液一定呈中性的是
A.c (H+) × c(OH-) =10-14的溶液
B.n(H+)=n(OH—) 的溶液
C.c (H+)=1.0×10-7 mol/L的溶液
D.pH=3的酸与pH=11的碱等体积混合后的溶液
5、选择题 某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取8.16mL稀盐酸
B.用托盘天平称取25.20gNaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL碱式滴定管进行中和滴定时,用去某浓度的碱溶液21.70mL