时间:2020-08-13 04:34:33
1、选择题 三种正盐的混合溶液中含有0.2 mol Na+,0.25 mol Mg2+,0.4 mol Cl-,则SO42-为
[? ]
A、0.1 mol
B、0.3 mol
C、0.5 mol
D、0.15 mol
参考答案:D
本题解析:
本题难度:简单
2、选择题 在T℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含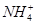 的物质的量为b mol。下列叙述中正确的是( )
的物质的量为b mol。下列叙述中正确的是( )
A.溶质的质量分数为w=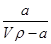 ×100%
×100%
B.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
C.溶液中c(OH-)=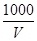 mol·L-1
mol·L-1
D.溶质的物质的量浓度c=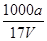 mol·L-1
mol·L-1
参考答案:D
本题解析:溶液的质量是Vρg,所以溶质的质量分数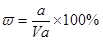 ,A不正确;氨水的密度小于水的,所以上述溶液中再加入V mL水后,所得溶液溶质的质量分数小于0.5w,B不正确;溶液中OH-的物质的量大于bmol,浓度大于
,A不正确;氨水的密度小于水的,所以上述溶液中再加入V mL水后,所得溶液溶质的质量分数小于0.5w,B不正确;溶液中OH-的物质的量大于bmol,浓度大于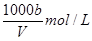 ,所以选项C不正确;溶质氨气的物质的量是a/17mol,所以溶液的浓度是c=
,所以选项C不正确;溶质氨气的物质的量是a/17mol,所以溶液的浓度是c=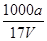 mol·L-1,D正确,答案选D。
mol·L-1,D正确,答案选D。
本题难度:一般
3、选择题 将新制氨气充满一干燥烧瓶(标准状况)再将烧瓶倒置于水中,当液面不再上升时,烧瓶中溶质的物质的量浓度为( )
A.
| 4 5 |
| 1 28 |
| 1 14 |
| 1 22.4 |
参考答案:氨气极易溶于水,将新制氨气充满一干燥烧瓶(标准状况)再将烧瓶倒置于水中,当液面不再上升时,溶液的体积等于气体的体积,根据C=nV=VVmV=1Vm=122.4mol/L,故选D.
本题解析:
本题难度:一般
4、选择题 下列说法正确的是
A.在标准状况下,1mol水的体积是22.4L
B.1molH2所占的体积一定是22.4L
C.在标准状况下,NA个任何分子所占的体积约为22.4L
D.在标准状况下,总质量为28g的N2和CO的混合气体,其体积约为22.4L
参考答案:D
本题解析:在标准状况下,水是液体无法计算体积,A错误;1molH2所占的体积一定是22.4L,没有条件无法计算体积,B错误;在标准状况下,NA个任何分子所占的体积约为22.4L,分子在标准状况下若是固体或液体则无法计算体积,C错误;在标准状况下,总质量为28g的N2和CO的混合气体,它们的摩尔质量相同,则它们的物质的量和一定为1mol,其体积约为22.4L,D正确。
考点:考查物质的量的计算等知识。
本题难度:一般
5、选择题 设nA为阿伏加德罗常数的值,下列说法正确的是(相对原子质量:C-l2 ?H-1)
A.2.24L NO2含有0.2nA个氧原子
B.常温常压下,C2H4和C3H6组成的28g混合气体中含4nA个氢原子
C.1 molC2H6分子中含有7nA个极性键
D.常温下pH=13的NaOH溶液中含有的0.1 nA个OH-
参考答案:B
本题解析:缺少“标准状况下”条件,气体摩尔体积不一定是22.4L/mol,二氧化氮也不一定是气体,无法确定二氧化氮的物质的量,A项错误;假设气体全部是C2H4,则n(C2H4)=28g÷28g?molˉ1=1mol,C2H4=2C+4H,根据系数之比等于物质的量之比,则n(H)= n(C2H4)×4=4mol;假设气体全部是C3H6,则n(C3H6)=28g÷42g?molˉ1=2/3mol,C3H6=3C+6H,根据系数之比等于物质的量之比,则n(H)= n(C3H6)×6=4mol;由于两个极限值相等,都等于4mol,则混合气体含有4mol氢原子,B项正确;乙烷分子由1个碳碳单键和6碳氢单键构成,同种非金属原子构成的碳碳单键是非极性键,不同种非金属原子构成的碳氢键是极性键,则1mol乙烷含有6mol极性键和1mol非极性键,C项错误;氢氧化钠是强碱,其溶液显碱性,由pH=13可知溶液中c(H+)=10ˉ13mol/L,由常温下Kw可知c(OHˉ)=0.1mol/L,但是不能确定溶液的体积,因此无法确定氢氧根的物质的量,D项错误。
本题难度:一般