时间:2020-08-13 04:33:30
1、选择题 如图是某无机化合物的二聚分子,该分子中A、B两种元素都是第三周期的元素,分子中所有原子的最外层电子都达到8个电子的稳定结构。下列说法不正确的是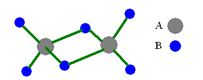
A.该化合物的化学式是Al2Cl6
B.该化合物在固态时所形成的晶体是分子晶体
C.该化合物是离子化合物,在熔融状态下能导电
D.该化合物中存在共价键,且不含有非极性共价键
参考答案:C
本题解析:A、正确;B、共价化合物,是分子晶体,正确;C、错误D、正确
本题难度:一般
2、简答题 现有部分短周期元素的性质或原子结构如下表:
| 元素 | 元素性质或原子结构 A 最外层电子数是次外层电子数的3倍 B 该元素是所有元素中非金属性最强的 C L层只有5个电子 D 第3周期元素的简单离子中半径最小 |
参考答案:短周期元素,由最外层电子数是次外层电子数的3倍,则A有2个电子层,最外层电子数为6,即A为O;所有元素中非金属性最强的元素是F,则B为F;C的L层只有5个电子,则C为N;第3周期元素的简单离子中半径最小的为铝离子,则D为Al,
(1)A为O,质子数为8,得到2个电子变为离子,离子结构示意图为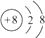
,C为N,其其它氢化物为氨气,电子式为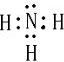
,
故答案为:
;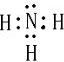
;
(2)所有元素中非金属性最强的元素是F,非金属性F>Cl,氟单质和溶液中的水反应,则不能置换出Cl,不能利用单质的颜色来比较非金属性,但在化合物中F显负价,则非金属性强,故答案为:F;b;?
(3)A、B、C、D四种元素中只有Al为金属,具有金属性,故答案为:Al;具有金属性.
本题解析:
本题难度:一般
3、选择题 共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是
[? ]
A.干冰?
B.氯化钠?
C.氢氧化钠?
D.碘
参考答案:B
本题解析:
本题难度:简单
4、选择题 下列电子式中,正确的是
[? ]
A.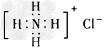 ?
?
B.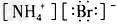 ?
?
C.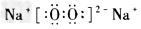 ?
?
D.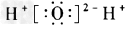 ?
?
参考答案:C
本题解析:
本题难度:简单
5、填空题 X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素.其中Y、W位于同一主族,Z、W位于同一周期,Y的最外层电子数是K层电子数的3倍,Z是同一周期中金属性最强的元素,X的最外层电子数与Z相同,但X为非金属元素.请回答下列问题:
(1)Y、Z的元素符号分别是______、______.
(2)Z2W的电子式是______,X2Y的结构式为______
(3)Z2Y2与X2Y反应的化学方程式是:______
(4)Z2WY3与X2WY4反应的离子方程式是:______.
参考答案:(1)Y的最外层电子数是K层电子数的3倍,则Y的最外层电子数为6,X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素,其中Y、W位于同一主族,则Y为O元素,W为S元素,Z是同一周期中金属性最强的元素,Z、W位于同一周期,则Z为Na元素,X的最外层电子数与Z相同,但X为非金属元素,则X为H元素,
故答案为:O;Na;
(2)Z2W为Na2S为离子化合物,电子式为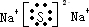
,X2Y为H2O,为极性分析,分子为V形,结构式为
,
故答案为:
;
;
(3)Na2O2与H2O反应生成NaOH和O2,反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(4)Na2SO3与H2SO4反应生成SO2,反应的化学方程式为,Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,反应实质为:SO32-+2H+=SO2↑+H2O,故答案为:SO32-+2H+=SO2↑+H2O.
本题解析:
本题难度:一般