时间:2020-07-28 05:08:30
1、填空题 甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5KJ热量,则甲烷燃烧的热化学方程式为______.
参考答案:0.25mol甲烷完全燃烧生成液态水时放出222.5KJ热量,1mol甲烷反应燃烧反应放热222.50.25=890KJ;反应的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890KJ/mol;
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890KJ/mol;
本题解析:
本题难度:一般
2、填空题 (1)北京奥运会“祥云”火炬用的是环保型气体燃料-丙烷(C3H8),已知0.1mol丙烷完全燃烧生成CO2气体和液态水放出的热量为222.15kJ,则丙烷燃烧的热化学方程式为______.
(2)在生物质能利用过程中,可将含糖类、淀粉[(C6H10O5)n]较多的农作物为原料在催化剂作用下,经水解和细菌发酵可以制得酒精(C2H5OH),它和汽油混合作为汽车的燃料.写出由淀粉制酒精的两步主要反应的化学方程式:______、______.
参考答案:(1)0.1mol丙烷完全燃烧放出222.15kJ,则1mol丙烷完全燃烧生成CO2气体和液态水放出的热量为2221.5kJ,
则丙烷燃烧的热化学方程式为C3H8(g)+5CO2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ/mol,
故答案为:C3H8(g)+5CO2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ/mol;
(2)由淀粉制酒精,淀粉首先水解生成葡萄糖,反应方程式为:C6H10O5)n+nH2O→nC6H12O6,
葡萄糖经细菌发酵可以制得酒精,反应方程式为:C6H12O6→2C2H5OH+2CO2,
故答案为:C6H10O5)n+nH2O→nC6H12O6;C6H12O6→2C2H5OH+2CO2.
本题解析:
本题难度:一般
3、填空题 (8分)甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。
已知:CH3OH(1) + O2(g) =" CO(g)" + 2H2O(g) △H = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) △H =-566.0 kJ·mol-1
(1)试写出2molCH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式:
(2)科研人员新近开发出一种由甲醇和氧气以强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,据此回答下列问题:
甲醇在 极反应;O2一极发生的电极反应方程式为
(3)若用该电池在某金属表面镀铜,若待镀金属的质量增加了6.4g,则至少消耗甲醇的质量为 g。
参考答案:(1) 2CH3OH(1) +3O2(g) = 2CO2(g) + 4H2O(g);△H =-1453.28kJ·mol-1
(2)负 极;电极反应方程式为O2+4e-+2H2O=4OH-
(3) 1.07 g。
本题解析:CH3OH(1) + O2(g) =" CO(g)" + 2H2O(g) △H1= -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) △H 2=-566.0 kJ·mol-1
2CH3OH(1) +3O2(g) = 2CO2(g) + 4H2O(g);△H =2△H1-△H 2=-1453.28kJ·mol-1
还原剂做负极,氧化剂做正极,O2+4e-+2H2O=4OH-
铜的物质的量为0.1mol , 至少消耗甲醇的质量为1.07g
本题难度:一般
4、填空题 (6分)拆开1mol H—H键,1mol N—H键,1mol N三N键分别需要吸收的能量为436kJ ,391kJ,946kJ:则理论上,每生成1mol NH3, 热量(填:吸收或放出) kJ;事实上,反应的热量总小于理论值,为什么?
参考答案:放出(2分),46.2(2分);该反应是可逆反应,充分反应的最终结果是达到最大限度(既化学平衡状态),因此放出的热量总是小于理论计算值。(2分)
本题解析:考查反应热的计算、化学反应能量变化的原因以及可逆反应的特点。在化学反应中断键是吸热的,形成化学键是放热的,如果断键吸收的能量高于形成化学键所放出的能量,则就是吸热反应,反之是放热反应。根据键能可知断键吸收的能量是436kJ×3+946 kJ=2254 kJ,形成化学键放出的能量是2×3×391 kJ=2346 kJ,所以是放热反应,即每生成2mol氨气放热是2346 kJ-2254 kJ=92 kJ,因此每生成1mol NH3放出46.kJ热量。因为氨气的合成是可逆反应,3魔力氢气和1mol氮气不可能生成2mol氨气,所以反应的热量总小于理论值。
本题难度:一般
5、填空题 (9分)(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1) 2NH3(g) +
2NH3(g) + 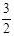 O2(g) ;△H =" a" kJ·mol—1
O2(g) ;△H =" a" kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 2NH3(g) ΔH= -92.4kJ·mol—1
2NH3(g) ΔH= -92.4kJ·mol—1 2H2O(l) ΔH = -571.6kJ·mol—1
2H2O(l) ΔH = -571.6kJ·mol—1参考答案:(1)①>、> (各1分)
②2N2(g) + 6H2O(1) = 4NH3(g) + 3O2(g) ΔH="+1530" kJ·mol-1 (2分)
或者N2(g) + 3H2O(1) = 2NH3(g) + 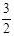 O2(g) ΔH="+765" kJ·mol-1 (2分)
O2(g) ΔH="+765" kJ·mol-1 (2分)
(2)①N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) △H="-512kJ." mol-1(2分)
②688(2分)③产物无污染(1分)
本题解析:(1)①随着温度的升高,氨气的含量逐渐增大,说明正反应是吸热反应。反应前后气体的体积是增大的,所以△S大于0。
②考查盖斯定律的应用。根据反应可知①×2-②×3即得到2N2(g) + 6H2O(1) = 4NH3(g) + 3O2(g),所以反应热是-92.4kJ·mol—1×2+571.6kJ·mol—1×3=+1530 kJ·mol-1。
(2)①根据题意可知,1mol肼完全燃烧放出的热量是256kJ×2=512kJ,所以热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) △H="-512kJ." mol-1。
②根据H2O(g)=H2O(l) △H=-44kJ?mol-1可知N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) △H="-688kJ." mol-1。32g液态肼是1mol,所以放出的热量是688kJ.
③由于肼的燃烧产物是氮气和水,产物无污染。
本题难度:一般