时间:2020-07-28 05:08:30
1、选择题 下列说法正确的是
[? ]
2、选择题 2003年10月15日我国成功发射了第一艘载人航天飞船“神舟五号”(下图)。从此我国进入了航天大国和航天强国行列。发射“神五”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:
N2(g)+ 2O2(g)=2NO2(g) △H=+67. 7kJ/mol。
N2H4(g)+O2(g)=N2(g)+ 2H2O(g) △H= - 534kJ/mol.。
下列关于肼和NO2反应的热化学方程式中,正确的是
[? ]
A. 2N2H4 (g) +2NO2(g)=3N2(g)+4H2O(l) △H= -1135. 7kJ/mol
B. 2N2H4 (g) +2NO2(g)=3N2(g)+4H2O(g) △H= -1000. 3kJ/mol
C. N2H4 (g) +NO2 (g)=3/2N2 (g) +2H2O(l) △H = -1135. 7kJ/mol
D. 2N2H4 (g) +2NO2 (g)=3N2 (g) +4H2O(g) △H = -1135. 7kJ/mol
3、填空题 (16分)
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
1/4CaSO4(s)+CO(g) ? 1/4CaS(s)+CO2(g) ?H1 = -47.3kJ?mol-1
② CaSO4(s)+CO(g) ? CaO(s)+CO2(g) +SO2(g) ?H2 = +210.5kJ?mol-1
③ CO(g) ? 1/2C(s)+1/2CO2(g) ?H3 = -86.2kJ?mol-1
(1)反应2CaSO4(s)+7CO(g) ? CaS(s)+ CaO(s)+6CO2(g)+ C(s) +SO2(g)
的?H=__________(用?H1、?H2和?H3表示)

(2)反应①-③的平衡常数的对数lgK随反应温度T的变化曲线见图18,结合各反应的?H,回答下列问题。a)曲线中对应反应②的是_______(选填“Ⅰ”或“Ⅱ”)。
归纳lgK-T曲线变化规律: b)_________ ________ 。
c)_____ ___ 。
(3)向盛有CaSO4的真空恒容密闭容器中充入初始浓度为C0 mol?L-1的CO,反应①于900℃
达到平衡,此时c平衡(CO)=8.0X10-5 mol?L-1。
d)用图18中相应的lgK的值计算CO的转化率(忽略副反应,计算结果保留两位有效数字)。
e) c(CO)随反应时间t的变化曲线如图19所示。
若保持其他条件不变,请在答题卡坐标图中分别画出升高反应温度(高于900℃)和降低反应温度(低于900℃)c(CO)随反应时间t的变化曲线图,并作相应的标注(忽略副反应)。
4、选择题 25℃、101kPa下,煤炭、氢气、天然气和甲醇(CH3OH)等几种燃料的热值(指一定条件下单位质量的物质完全燃烧所放出的热量)依次是33kJ?g-1、143kJ?g-1、56kJ?g-1、23kJ?g-1,则下列热化学方程式正确的是?( )
A.C(s)+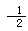 O2(g)=CO(g)△H=-396kJ?mol-1
O2(g)=CO(g)△H=-396kJ?mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-896kJ?mol-1
C.2H2(g)+O2(g)=2H2O(l)△H=-286kJ?mol-1
D.CH3?OH(l)+ O2(g)=CO2(g)+2H2O(l)△H=+736kJ?mol-1
O2(g)=CO2(g)+2H2O(l)△H=+736kJ?mol-1
5、填空题 (15分)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出肼和过氧化氢的结构式。肼__________________,过氧化氢______________ 。
(2)写出热化学方程式_________________________________________________。
(3)已知H2O(1)==H2O(g) △H=+44kJ/mol,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是_____________________ kJ。
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是________________________________________________________。