时间:2020-07-28 04:54:56
1、填空题 (4分)取体积相同(25mL)的两份0.10mol·L-1NaOH溶液,将其中一份放在空气中一段时间后,溶液的PH (填“增大”、“减小”或“不变”),其原因是 。用已知浓度的盐酸中和上述两份溶液,若中和放置空气中一段时的那份消耗盐酸的体积为VA,另一份消耗盐酸的体积为VB,则
(1)以甲基橙为指示剂时,VA与VB的关系是 。
(2)以酚酞为指示剂时,VA和VB的关系是  。
。
参考答案:减小;由于NaOH要与空气中的CO2反应生成Na2CO3,使NaOH的量减少,而使PH减小;VA=VB; VA<VB
本题解析:略
本题难度:简单
2、选择题 下列事实一定能说明HF是弱酸的是
①常温下NaF溶液的pH大于7 ②用HF溶液做导电性实验,灯泡很暗
③HF与NaCl不能发生反应 ④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体 ⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
A.①②⑦
B.②③⑤
C.③④⑥
D.①④
参考答案:D
本题解析:①常温下NaF溶液的pH大于7,说明氟离子发生水解,使溶液呈碱性,则HF是弱酸,正确; ②用HF溶液做导电性实验,灯泡很暗,说明HF溶液中的离子浓度较小,但不能证明HF是弱酸,错误;
③HF与NaCl不能发生反应,不能证明HF是弱酸,错误;④常温下0.1mol/L的HF溶液的pH为2.3>1,说明HF未完全电离,说明HF是弱酸,正确;⑤HF能与Na2CO3溶液反应,产生CO2气体,说明HF比碳酸的酸性强,不能说明HF是弱酸,错误;⑥HF与水能以任意比混溶,溶解性与酸的强弱无关,错误;⑦1mol/L的HF水溶液能使紫色石蕊试液变红,说明HF的溶液显酸性,不能说明其为弱酸,错误,答案选D。
考点:考查弱酸的判断
本题难度:一般
3、填空题 (8分)水的电离平衡曲线如下图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,Ca(OH)2的离子积为 。
(4))25℃时,在等体积的① pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
参考答案:(8分)(1)10-14 10-12各1分
(2)2:9 2分
(3)0.004 2分
(4)1:10:10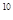 :10
:10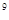 2分
2分
本题解析:略
本题难度:简单
4、选择题 室温下,取0.3 mol/L HY溶液与0.3 mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是
[? ]
A. 混合溶液中由水电离出的c(OH-)=10-9 mol/L
B. 溶液中离子浓度由大到小的顺序为c(Y-)>c(Na+)>c(OH-)>c(H+)
C.c(OH-)-c(HY)=c(H+)=1×10-9 mol/L
D. c(Na+) =c(Y-)+c(HY) =0.3 mol/L
参考答案:C
本题解析:
本题难度:一般
5、选择题 有一支50 mL酸式滴定管,其中盛有溶液,液面恰好在10.0 mL刻度处,把滴定管的溶液全部流下排出,盛接在量筒中,量筒内溶液的体积是( )
A.大于40.0 mL
B.大于10.0 mL
C.为40.0 mL
D.为10.0 mL
参考答案:A
本题解析:
试题解析:滴定管的刻度自上而下是递增的,即50ml刻度线在下面。但50ml刻度线下面的一部分是没有刻度的,所以如果把滴定管中的液体全部流下排出,则其体积一定大于40.00ml。
考点:滴定管的结构特点
本题难度:一般