时间:2020-07-28 04:33:22
1、选择题 [2012·太原二模]在T℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含NH的物质的量为b mol。下列叙述中正确的是( )
A.溶质的质量分数为w=×100%
B.溶质的物质的量浓度c= mol·L-1
C.溶液中c(OH-)= mol·L-1
D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
参考答案:B
本题解析:根据题中给出的已知量及各选项的要求,利用待求量的最基本计算关系代入求解即可。A不正确,w应为×100%;根据公式c=进行计算知B正确;由溶液中的电荷守恒可知c(OH-)= mol·L-1+c(H+),C错误;因为氨水的密度小于水的密度,故上述溶液再加V mL水后,所得溶液溶质的质量分数小于0.5w,故D不正确。
本题难度:简单
2、填空题 pH = 2与pH = 5的两强酸溶液各10 mL,混合后溶液的pH为?。
参考答案:3-lg5
本题解析:考查溶液pH的计算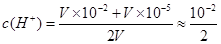 ,pH=lg
,pH=lg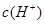 =3-lg5
=3-lg5
本题难度:简单
3、选择题 下列溶液,加热后颜色变浅的是
A.稀氨水和酚酞溶液
B.滴有酚酞的Na2CO3溶液
C.溶有氯气的品红溶液
D.溶有SO2的品红溶液
参考答案:A
本题解析:略
本题难度:简单
4、选择题 下列说法中,能说明乙醇(酒精)作为燃料的优点是?
①燃烧时发生氧化反应?②乙醇是一种可再生能源
③燃烧时放出大量热能?④充分燃烧的产物不污染环境
A.①②③
B.①②④
C.①③④
D.②③④
参考答案:D
本题解析:乙醇的燃烧放出大量的热,同时产物是水和CO2,对环境没有污染,且乙醇也是一种可再生能源,所以答案选D。
点评:本题容易错选①,因为任何燃烧都是氧化还原反应,不能作为优点。
本题难度:一般
5、填空题 (6分)炭火炉内的炭燃烧至炽热时,在往炉膛底的热炭上喷洒少量水的瞬间,炉火更旺,这是因为?。
如果烧去“同量的炭,喷洒过水和没有洒过水的炭火炉相比,放出的总能量?(填“相同”或“不相同”),原因是? ? 。
参考答案:(每空2分,共6分)
生成的水煤气(CO和H2)燃烧,使得瞬间火焰更旺;相同;生成水煤气所吸收的热量和水煤气燃烧时增加的热量相同
本题解析:本题主要考查了生活现象与燃烧的相关知识,涉及到水的气化、盖斯定律等知识点,其中的反应为:
C+O2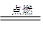 2CO2
2CO2
C+H2O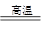 CO+H2? 2CO+O2
CO+H2? 2CO+O2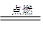 2CO2?2H2+O2
2CO2?2H2+O2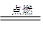 2H2O
2H2O
本题难度:简单