时间:2020-07-28 04:00:24
1、填空题 按要求填空:
(1)原子种类由 决定;第三周期半径最小的元素形成的简单离子的离子结构示意图是 ;
(2)以黄铁矿为原料生产硫酸的工艺流程如下左图所示,设备B的名称为 ;设备A中发生反应的化学方程式 ;
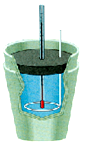
(3)如下右图是实验室中常用于测定盐酸和氢氧化钠溶液反应热的装置,此装置名称叫 ;
(4)0.5 mol CH3OH(l)完全燃烧生成二氧化碳气体和液态水时放出热量为363.2 kJ,写出表示CH3OH(l)燃烧热的热化学方程式 。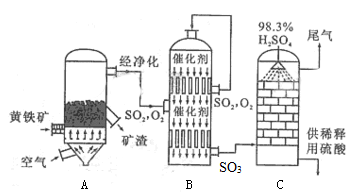
参考答案:(1)质子数和中子数或质子数和质量数 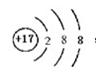
(2)接触室 
(3) 简易量热计 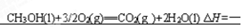
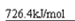
本题解析:原子种类由质子数和中子数或质子数和质量数,同周期中,原子半径随原子序数的增大而减小,因此第三周期半径最小的元素是氯元素,所以它的离子结构示意图是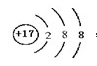 。设备B的名称为接触室。以黄铁矿为原料生产硫酸的工艺流程中,在接触室主要发生了
。设备B的名称为接触室。以黄铁矿为原料生产硫酸的工艺流程中,在接触室主要发生了 。测定盐酸和氢氧化钠溶液反应热主要的仪器是简易量热计。书写燃烧热时需注意要标出各物质的状态,以及燃耗热是指燃耗一摩尔燃料,生物稳定的物质所释放出来的热量,因此甲醇的燃烧热化学方程式为
。测定盐酸和氢氧化钠溶液反应热主要的仪器是简易量热计。书写燃烧热时需注意要标出各物质的状态,以及燃耗热是指燃耗一摩尔燃料,生物稳定的物质所释放出来的热量,因此甲醇的燃烧热化学方程式为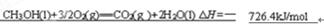
考点:考查原子种类决定因素以及工业制备硫酸及燃烧热的相关知识
本题难度:一般
2、选择题 常温下,将V1mL c1mol/L的醋酸滴加到V2mL c2mol/L的氢氧化钠溶液中,下列结论正确的是
A.若将c1mol/L的醋酸冲稀10倍,则其pH增大1
B.若将c2 mol/L的氢氧化钠溶液冲稀10倍,则其pH减小1
C.若c1? V1=c2?V2,则混合液中c(CH3COO-)=c(Na+)
D.若混合液的pH=7,则混合液中c(CH3COO-)=c(Na+)
参考答案:BD
本题解析:强酸稀释10倍后其pH增大1,醋酸是弱酸,稀释能促进其电离出氢离子,因此醋酸稀释10倍后其pH增大但是增大程度小于1,故A错误;氢氧化钠是强碱,稀释10倍后其pH减小1,弱碱稀释10倍后其pH减小但是减小程度小于1,因为稀释能促进弱碱电离出氢氧根离子,故B正确;若c1? V1=c2?V2,则醋酸的物质的量与氢氧化钠相等,则二者恰好完全中和,得到醋酸钠溶液,CH3COONa是强碱弱酸盐,其完全电离出的钠离子不能水解,醋酸根离子部分水解,所以溶液中c(CH3COO-)<c(Na+),故C正确;醋酸和氢氧化钠混合溶液中含有CH3COO-、OH-、Na+、H+,溶液呈电中性,遵循电荷守恒原理,则c(CH3COO-)+c(OH-)=c(Na+)+c(H+),若混合溶液pH=7,则c(OH-)=c(H+),所以c(CH3COO-) =c(Na+),故D正确。
本题难度:简单
3、选择题 白磷会对人体造成严重的烧伤,白磷(P4)分子结构为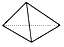 。2009年1月11日,国际人权组织--人权观察曾在其报告中指责以色列在加沙人口稠密地区使用了违禁武器。该组织在报告中指出,以军在轰炸和炮击加沙地区时使用了白磷炸弹。下列说法不正确的是
。2009年1月11日,国际人权组织--人权观察曾在其报告中指责以色列在加沙人口稠密地区使用了违禁武器。该组织在报告中指出,以军在轰炸和炮击加沙地区时使用了白磷炸弹。下列说法不正确的是
[? ]
A.白磷着火点低,在空气中可自燃
B.白磷、红磷为同素异形体
C.31 g白磷中,含P-P键1.5 mol
D.已知P4(白磷)+3O2(g)=2P2O3(s) ΔH=-Q kJ·mol-1,则白磷的燃烧热为Q kJ·mol-1
参考答案:D
本题解析:
本题难度:简单
4、选择题 下列热化学方程式中ΔH的数值表示可燃物燃烧热的是
A.N2H4(g)+O2(g)===N2 (g)+ 2H2O(g)ΔH=-534.4 kJ·mol-1
B.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1
D.CO(g)+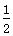 O2(g)===CO2(g)ΔH=-283 kJ·mol-1
O2(g)===CO2(g)ΔH=-283 kJ·mol-1
参考答案:D
本题解析:根据燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,如C→CO2(g)、H→H2O(l)S→SO2 (g),A、B.应该生成液态水时所放出的热量,A、B错误;C、氢气的物质的量应该为1mol时放出的热量为燃烧热,C错误;D、一氧化碳完全燃烧生成二氧化碳,故D正确,答案选D.
考点:燃烧热的定义
本题难度:一般
5、选择题 强酸和强碱的稀溶液的中和热可表示为:
H+(aq)+OH-(aq)=H2O(1)?△H =-57.3kJ/mol
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O?△H ="-" Q1kJ/mol
1/2 H2SO4(浓)? +? NaOH(aq) ="=" 1/2Na2SO4(aq) +H2O(1)?△H ="-" Q2kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1)?△H ="-" Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为(? )
A.Q1=Q2=Q3
B.Q2>Q1>Q3
C.Q2>Q3>Q1
D.Q2=Q3>Q1
参考答案:C?
本题解析:△H =-57.3kJ/mol表示的是强酸与强碱的稀溶液的中和热Q3=57.3;CH3COOH与NaOH中和反应时放热,但由于醋酸的不断电离会吸收热量,因此最终放出的热量Q1比57.3少;浓硫酸与NaOH溶液中和的同时也在被稀释,因此放出的热还包含溶解放出的热,Q2>57.3。
本题难度:一般