时间:2020-07-28 04:00:24
1、实验题 (满分12分)用中和滴定法测定某烧碱样品的纯度。
⑴配制待测液: 将0.85g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成100mL溶液,所用的主要仪器有___________________________________________。
⑵滴定: ①盛装0.20mol/L盐酸标准液应该用_______滴定管。
②滴定时,应先向锥形瓶中加酚酞作为指示剂;滴定过程中两眼应该注视________,滴定终点时,锥形瓶中的溶液的颜色变化是__________。
③有关数据记录如下:
| 滴定序号 | 待测液体积 (mL) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 26.00 |
参考答案:(1)烧杯、玻璃棒、100mL容量瓶、胶头滴管(2分);
(2)①酸式 (1分),?②锥形瓶内溶液的颜色变化和滴定速度(2分);
红色刚好变成无色且30秒钟内不恢复原色(1分)。
⑶ 0.201 (2分),? 94.6%(2分);?
⑷ ①偏低(1分),?② 偏低(1分)。
本题解析:(1)考查常见的基本实验操作。准确配制一定物质的量浓度的溶液所需要的主要仪器有容量瓶、烧杯、玻璃棒和胶头滴管。
(2)滴定管分为酸式和碱式两种滴定管。盐酸应放在酸式滴定管中。在滴定过程中,眼睛必须注视锥形瓶内溶液颜色的变化。用酚酞作指示剂,盐酸滴定氢氧化钠溶液终点的颜色变化为溶液由红色变为无色,且在半分钟内不褪色。
(3)两次实验中消耗盐酸的体积分别是20.20ml和20.00ml,所以平均值为2010ml,因此氢氧化钠的浓度是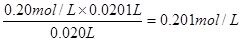 。所以样品的纯度是
。所以样品的纯度是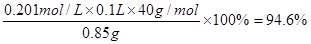 。
。
(4)若刚见到指示剂局部的颜色有变化就停止滴定,说明盐酸不足,测定结果偏低。若滴定前仰视,读数偏大,滴定后俯视,读数偏小,所以消耗的盐酸体积偏小,测定结果偏低。
本题难度:简单
2、填空题 人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。我们目前中学课本中的酸碱理论是1887年阿仑尼乌斯(Arrhenius)提出了的电离理论。
(1)1905年富兰克林(Franklin)把阿仑尼乌斯以水为溶剂的个别现象,推到任何溶剂,提出了酸碱溶剂理论。溶剂理论认为:凡能离解而产生溶剂正离子的物质为酸,凡能离解而产生溶剂负离子的物质为碱。试写出五氯化磷在某条件下自身电离的方程式:
?▲?(一种为正四面体阳离子,另一种为正八面体阴离子)。
(2)1923年丹麦化学家布朗斯物(Brφusted)和英国化学家劳莱(Lowry)提出了质子论。凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。按质子理论:下列粒子在水溶液既可看作酸又可看作碱的是?▲?。
A.HSO3-
B.NH4+
C.OH-
D.HCO3- E.CH3COO- F.Cl-
(3)1923年路易斯(Lewis)提出了广义的酸碱概念。凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合的物质都是酸。如:
酸(电子对接受体)?碱(电子对给予体)?反应产物
H+ +? [∶OH ]—?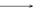 ?H∶OH
?H∶OH
试指出下列两个反应中的酸或碱
①H3BO3? + H2O? = H+?+ B(OH)4- ?该反应中的碱是?▲?(填:H3BO3或 H2O)
②BF3?+ NH3? = BF3· NH3?该反应中的酸是?▲?(填:BF3?或 NH3)
参考答案:(1)2PCl5 ?PCl4++PCl6-(2分)
?PCl4++PCl6-(2分)
(2)AD(2分)(3)H2O(1分);BF3(1分)
本题解析:
(1)2PCl5 ?PCl4++PCl6-
?PCl4++PCl6-
(2)选AD,B是酸,C、E、F是碱;(3)H2O提供电子对是碱;BF3中B有空轨道,结合电子对,是酸。
本题难度:一般
3、选择题 常温下取浓度相同的NaOH和HCl溶液,以3∶2 体积比相混合,所得溶液的pH 等于12,则原溶液的浓度为(?)
A.0.01 mol?L-1
B.0.017 mol?L-1
C.0.05 mol?L-1
D.0.50 mol?L-1
参考答案:C
本题解析:考查pH的有关计算。根据题意氢氧化钠是过量的,反应后溶液中OH-的浓度是0.01mol/L,所以有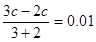 ,解得c=0.05mol/L,答案选C。
,解得c=0.05mol/L,答案选C。
本题难度:一般
4、选择题 下列说法正确的是(?)
A.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小
B.配制溶液时,若在定容时仰视读数,会导致所配标准溶液的浓度偏大。
C.中和等体积、等物质的量的浓度的盐酸和醋酸所消耗的n(NaOH)相等
D.25℃与60℃时,水的pH相等
参考答案:C
本题解析:容量瓶中含有蒸馏水不影响浓度,A不正确。定容时仰视,则容量瓶中溶液的体积偏大,浓度偏小,B不正确。等体积、等物质的量的浓度的盐酸和醋酸的物质的量是相等的,所以消耗的氢氧化钠是相等的,C正确。水是弱电解质,存在电离平衡,加热促进电离,所以25℃与60℃时,水的pH不相等,D不正确,答案选C。
本题难度:简单
5、选择题 有两种溶液,pH分别为3和5,这两种溶液的[H+]之比是
A.3∶5
B.5∶3
C.100∶1
D.1∶100
参考答案:D
本题解析:pH=3,[H+]1=10-3;pH=5,[H+]2=10-5,所以[H+]1∶[H+]2=10-3∶10-5=100∶1
本题难度:一般