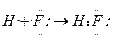时间:2020-07-28 03:40:45
1、选择题 已知化学反应A2(g)+B2(g)===2AB(g) ΔH= Q kJ·mol-1,其能量变化如下图所示,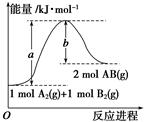
则Q的值正确的是
A.a-b
B.a
C.-b
D.b-a
2、填空题 (15分)二甲醚与水蒸气重整制氢气作为燃料电池的氢源,比其他制氢技术更有优势。主要反应为:
① CH3OCH3(g) + H2O(g) 2CH3OH(g)? ΔH=+37 kJ·mol-1
2CH3OH(g)? ΔH=+37 kJ·mol-1
② CH3OH(g) + H2O(g)  3H2(g) + CO2(g)? ΔH=+49 kJ·mol-1
3H2(g) + CO2(g)? ΔH=+49 kJ·mol-1
③ CO2(g) + H2(g) CO(g) + H2O(g)? ΔH=+41.3 kJ·mol-1
CO(g) + H2O(g)? ΔH=+41.3 kJ·mol-1
其中反应③是主要的副反应,产生的CO能毒害燃料电池Pt电极。请回答下列问题:
(1)二甲醚可以通过天然气和CO2合成制得,该反应的化学方程式为
?。
(2)CH3OCH3(g)与水蒸气重整制氢气的热化学方程式为
?。
(3)下列采取的措施和解释正确的是?。(填字母序号)
A.反应过程在低温进行,可减少CO的产生?
B.增加进水量,有利于二甲醚的转化,并减少CO的产生
C.选择在低温具有较高活性的催化剂,有助于提高反应②CH3OH的转化率
D.体系压强升高,对制取氢气不利,且对减少CO的产生几乎无影响
(4)在温 度相同的3个密闭容器中,按不同方式
度相同的3个密闭容器中,按不同方式 投入反应物,保持恒温、恒压,发生反应①,测得反应达到平衡时的有关数据如下。
投入反应物,保持恒温、恒压,发生反应①,测得反应达到平衡时的有关数据如下。
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CH3OCH3、1mol H2O | 2mol CH3OH | 1mol CH3OH |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 吸收a kJ | 放出b kJ | 放出c kJ |
| 平衡时体积(L) | V1 | V2 | V3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
 C. V1 > V3?D. c1=
C. V1 > V3?D. c1= 2c3
2c3 ?。
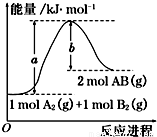
?。3、选择题 下列各项表述与示意图一致的是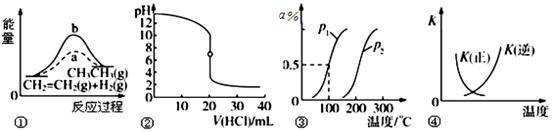
A.图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g) →CH3CH3(g) +ΔQ ,0<ΔQ;使用和未使用催化剂时,反应过程中的能量变化
B.图②表示25 ℃时,用0.01 mol·L-1盐酸滴定一定体积的0.01 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
C.图③表示CH4(g)+H2O(g) CO(g)+3H2(g) +ΔQ ,反应CH4的转化率与温度、压强的关系,且p1>p2、0<ΔQ
CO(g)+3H2(g) +ΔQ ,反应CH4的转化率与温度、压强的关系,且p1>p2、0<ΔQ
D.图④中曲线表示反应2SO2(g)+O2(g)  2SO3(g) +ΔQ ,0<ΔQ;正、逆反应的平衡常数K随温度的变化
2SO3(g) +ΔQ ,0<ΔQ;正、逆反应的平衡常数K随温度的变化
4、选择题 已知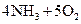 ══
══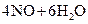 ,反应速率分别用
,反应速率分别用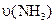 、
、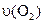 、
、
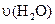 表示,下列关系正确的是(? )
表示,下列关系正确的是(? )
A.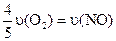
B.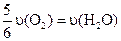
C.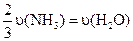
D.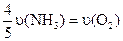
5、选择题 下列用电子式表示物质的形成过程中正确的是(?)
A.Na·+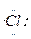 →[Na]+[
→[Na]+[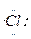 ]-
]-
B.

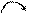
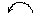
C.Na·+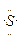 +·Na→Na+[
+·Na→Na+[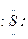 ]2-Na+
]2-Na+
D.