时间:2020-07-28 03:40:45
1、填空题 (1)0.3 mol气态高能燃料乙硼烷(分子式B2H6),在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,则其热化学方程式为
(2)又已知:H2O(g) =H2O(l) ; ΔH="-44" kJ/mol,则5.6L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是 。
参考答案:B2H6(g)+3O2=B2O3(s)+3H2O(l) ΔH=-2165 kJ/mol 508.25 kJ
本题解析:(1)根据题意可知,1mol气态高能燃料乙硼烷完全燃烧放出的热量是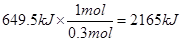 ,所以该反应的热化学方程式为B2H6(g)+3O2=B2O3(s)+3H2O(l) ΔH=-2165 kJ/mol。
,所以该反应的热化学方程式为B2H6(g)+3O2=B2O3(s)+3H2O(l) ΔH=-2165 kJ/mol。
(2)根据盖斯定律可知,乙硼烷完全燃烧生成气态水时热化学方程式是B2H6(g)+3O2=B2O3(s)+3H2O(g) ΔH=-(2165-44×3)kJ/mol=-2033 kJ/mol。5.6L(标准状况)乙硼烷物质的量是0.25mol,所以乙硼烷完全燃烧生成气态水时放出的热量是2033 kJ/mol×0.25mol=508.25 kJ。
考点:考查热化学方程式的书写以及反应热的有关计算
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练。旨在培养学生的规范答题能力。该题的关键是明确反应热的含义、计算依据以及热化学方程式的书写注意事项,然后结合题意灵活运用即可。
本题难度:一般
2、选择题 下列关于化学键的说法正确的是:
①HF是一种非常稳定的化合物,这是因为分子间存在氢键
②NaCl熔化离子键发生了破坏
③CO2、SiO2熔点后者高是因为前者克服分子间作用力后者熔化破坏共价键
④活泼金属与非金属化合时,一定能形成离子键
⑤离子化合物中可能同时含有离子键和共价键
⑥由非金属元素形成的化合物一定不是离子化合物
⑦单质分子中一定含非极性键
A.①②⑤
B.④⑥⑦
C.①③④
D.②③⑤
参考答案:D
本题解析:①HF是一种非常稳定的化合物,这是因为F与H之间存在强的吸引力,所以①错误,④活泼金属与非金属化合时,不一定能形成离子键,例如Al和Cl,⑥由非金属元素形成的化合物不一定是离子化合物,例如氯化铵,⑦单质分子中不一定含非极性键,例如稀有气体,就不含非极性键,②③⑤的说法正确,所以答案为D。
点评:本题考查了化学键的相关知识,属于对基础知识的考查,本题综合性较大,有一定的难度。
本题难度:简单
3、填空题 ①CaCO3 ="=" CaO + CO2;ΔH= +177.7kJ/mol
②C(s) + H2O(g)="=" CO(g) + H2(g);ΔH= -131.3kJ
③0.5H2SO4(l) + NaOH(l) ="=" 0.5Na2SO4(l) + H2O(l);ΔH=+57.3kJ/mol
④C(s) + O2(g) ="=" CO2(g);ΔH=-393.5kJ/mol
⑤CO(g) + 1/2 O2(g) ="=" CO2(g);ΔH=-283kJ/mol
⑥HNO3 (aq) + NaOH(aq) ="=" NaNO3(aq) + H2O(l);ΔH= -57.3kJ/mol
⑦2H2(g) + O2(g) ="=" 2H2O(l);ΔH= -517.6kJ/mol
(1)上述热化学方程式中,不正确的有( )
(2)根据上述信息,写出C转化为CO的热化学方程式 。
(3)上述反应中,表示燃烧热的热化学方程式有( );表示中和热的热化学方程式有( )。
参考答案:(1)①②③ (2)C(s) + 1/2 O2(g) ="=" CO2 (g);ΔH=-110.5kJ/mol (3)④⑤;⑥
本题解析:
试题解析:(1))①中没标物质状态,故错误;②中焓变单位应为.KJ/mol,故错误; ③除H2O外其它物质的状态不是“l”应为“aq”,故错误。(2)根据盖斯定律,?-?得:C(s) + 1/2 O2(g) ="=" CO2 (g);ΔH=-110.5kJ/mol。(3)燃烧热指1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,故表示燃烧热的热化学方程式有④⑤; 中和热指强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量,故表示中和热的热化学方程式有⑥。
考点: 盖斯定律的应用
本题难度:一般
4、选择题 2-丁炔与1,3-丁二烯分别跟氢气反应的热化学方程式如下: CH3—C≡C—CH3(g)+2H2(g)→CH3CH2CH2CH3(g)+Q1 ;CH2=CH—CH=CH2(g)+2H2(g)→CH3CH2CH2CH3(g)+Q2
已知:Q1 >Q2(Q1和Q2均大于零),由此不能判断
A.2-丁炔与1,3-丁二烯稳定性的相对大小
B.2-丁炔与1,3-丁二烯分子储存能量的相对高低
C.2-丁炔与1,3-丁二烯相互转化的热效应
D.一个碳碳叁键的键能与两个碳碳双键的键能之和的大小
参考答案:D
本题解析:A.物质含有的能量越低,稳定性就越强。由于二者发生加成反应时放出的热量前者大于后者,所以稳定性:CH2=CH—CH=CH2(g)> CH3—C≡C—CH3(g),故选项A正确;B.物质本身储存的能量越多,发生反应时释放的能量就越多,由于二者发生加成反应时释放能量不同,故可以比较2-丁炔与1,3-丁二烯分子储存能量的相对高低,正确;C.由于2-丁炔发生完全加成时释放的能量高于1,3-丁二烯,则由2-丁炔转化为1,3-丁二烯会释放热量,故可以判断相互转化的热效应,正确;D.在两种物质分子中含有的原子基团不同,故不能判断一个碳碳叁键的键能与两个碳碳双键的键能之和的大小,错误。
考点:考查物质反应的热化学方程式的应用的知识。
本题难度:一般
5、选择题 某溶液能与铝反应,且放出的气体只有氢气,下列各组离子在该溶液中一定能大量共存的是
A.NH4+、Na+、SO42-、OH-
B.K+、Na+、SO42-、Cl-
C.Mg2+、Cl-、NH4+、HCO3-
D.Ba2+、K+、Cl-、NO3-
参考答案:B
本题解析:分析:溶液能与铝反应,且放出的气体只有氢气,则溶液为酸或强碱溶液,再结合离子之间不能结合生成水、气体、沉淀、弱电解质等,则离子能大量共存.
解答:溶液能与铝反应,且放出的气体只有氢气,则溶液为酸或强碱溶液,
A.因NH4+、OH-能结合生成弱电解质,则不能共存,故A不选;
B.无论酸或碱溶液,该组离子之间不反应,能共存,故B选;
C.因HCO3-既能与酸反应又能与碱反应,则一定不能能够共存,故C错误;
D.碱溶液中该组离子之间不反应,酸溶液中Al、NO3-发生氧化还原反应不生成氢气,故D错误;
故选B.
点评:本题考查离子的共存,明确题目中的信息及常见离子之间的反应即可解答,注意选项D为解答的易错点,题目难度不大.
本题难度:一般