时间:2020-07-28 03:30:21
1、实验题 四氯化锡常温下是无色液体,在空气中极易水解,熔点-36℃,沸点114℃;金属锡的熔点为231℃,拟用以下仪器,设计组装一套实验装置,用熔融的金属锡跟干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热)请回答下列各个问题。
A.用玻璃管(未画出)连接上述装置,正确的顺序是(填各接口的代字母)
( )接( )、( )接( )、( )接( )、( )接( )、( )接( );
B.装置Ⅵ作用是______;装置Ⅳ的作用是______;
C.冷凝管里冷水的流向是从______进入,从________流出;
D.实验时应先点燃_______处酒精灯,加热温度应大于______℃,待_______即可停止加热;
E.已知四氯化锡遇水强烈水解,产物之一是固态二氧化锡,那么四氯化锡水解的化学方程式为_______。
F.如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是________。
G.为了防止污染空气,在装置的最后应_______。
2、选择题 下列实验方案设计正确的是
[? ]
A.分解高锰酸钾制取氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤
B.失去标签的AgNO3溶液、稀盐酸、NaOH溶液、AlCl3溶液可选用?(NH4)2CO3溶液作鉴别试剂
C.用铜丝代替铂丝做焰色反应
D.在裂化汽油中加入酸性高锰酸钾,振荡后若紫色褪去即可证明其中含甲苯等苯的同系物
3、实验题 某学生课外活动小组,模拟呼吸面具中的反应原理,设计用下图所示的仪器来制取氧气并测量氧气的体积。图中量气装置E由甲、乙两根玻璃管组成,它们由橡皮管连通,并装入适量水。甲管有刻度(0—50?mL),供量气用;乙管可上下移动调节液面高低。实验可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。? 
试完成下列问题:
(1)图中各装置接口连接顺序是____________(填各接口的编号,其中连接胶管及夹持装置均省略)。
(2)装置C中放入的反应物是____________和____________。
(3)装置A的作用是__________________,装置B的作用是_________________。
(4)为了较准确测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数及求其差值的过程中,应注意__________和__________(填字母编号)。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙两管液面相平
4、选择题 下列实验操作中,先后顺序正确的是?(?)
A.在进行中和滴定是,先固定沉定管,后润洗、装液
B.测定硫酸铜晶体的结晶水含量时,先称取一定量的晶体,后放入坩埚
C.为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
D.实验室抽取干燥纯净的氯气时,先使氯气通过饱和食盐水,后通过浓硫酸
5、选择题 下列有关实验操作、原理或现象叙述正确的是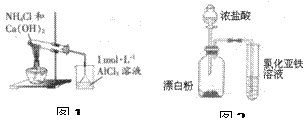
A.除去KCl溶液中混有的BaCl2,所加试剂的顺序: Na2CO3溶液、HCl溶液
B.图1烧杯中先出现白色沉淀后溶解
C.用如图2装置验证氧化性:ClO->Cl2>Fe3+
D.在NaHSO3溶液中滴入石蕊试液,验证溶液NaHSO3中存在水解平衡