时间:2020-07-08 01:52:24
1、选择题 原子序数依次相差1,且由小到大排列的A、B、C、D、E五种短周期元素。下列是有关这五种元素的叙述:?
①若A的最高价氧化物的水化物是强碱,则E的最高价氧化物的水化物是强酸
②若A的单质既能与强酸又能与强碱反应且都放出氢气,则这五种元素在同一周期
③若A的阳离子比E的阴离子少8个电子,则D一定是非金属元素
④若D的最高价氧化物的水化物是强酸,则E的单质在常温下为气态
⑤若B的单质是原子晶体,则B的氧化物是分子晶体
参考答案:B
本题解析:①不正确,例如A是Na,则E是P。⑤不正确,例如硅是原子晶体,二氧化硅也是原子晶体。其余都是正确的,答案选B。
本题难度:简单
2、填空题 (13分)下表是元素周期表的一部分,其中所列字母分别代表某一元素。
请你根据表中所给元素,回答下列问题:
(1)最外层上未成对电子数最多的元素是?(填元素符号)(1分)
(2)f单质及Fe单质的融合物两者所属晶体类型是?。(1分)
(3)原子核p亚层有两个空轨道的元素为?(填写元素名称),(1分)该元素最高价氧化物及最高价氧化物的水化物的化学性质相似,可以从两方面去把握,即:?;写出工业上利用该氧化物制取单质的化学方程式?;写出往该元素氯化物中滴加足量浓氨水的离子方程式?。
(4)单质在空气中燃烧,产生两种粉末状固体化合物的元素是?(填元素符号)。
(5)用来组成酸、碱、盐三类物质至少需要的元素有?(填写表中字母)。
参考答案:(1)N(2)金属晶体(3)?铝
既能与强酸溶液反应,又能与强碱溶液反应? 2Al2O3(熔融) 4Al+3O2↑
4Al+3O2↑
Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(4)Mg?(5)a? c? d
本题解析:根据元素的位置可知,a是H,B是He,c是N,d是O,e是Mg,f是Al,g是S,h是Cl。
(1)最外层上未成对电子数最多的元素是N共有3个。
(2)铝和铁都是金属,所以二者的融合物两者所属晶体类型是金属晶体。
(3)原子核p亚层有两个空轨道的元素为Al。氢氧化铝和氧化铝都是两性化合物,这是因为它们既能与强酸溶液反应,又能与强碱溶液反应。铝是活泼的金属,应该通过电解法,方程式为2Al2O3(熔融) 4Al+3O2↑。氢氧化铝是两性化合物,但不能溶于氨水中,方程式为
4Al+3O2↑。氢氧化铝是两性化合物,但不能溶于氨水中,方程式为
Al3++3NH3·H2O=Al(OH)3↓+3NH4+。
(4)镁能和氧气反应生成氧化镁,也能和氮气反应生成氮化镁。
(5)用来组成酸、碱、盐三类物质至少需要的元素有H、N、O。
本题难度:一般
3、选择题 右图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是 ?
?
A.原子半径:R>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成的化合物具有挥发性
D.Z能和Y的最高价氧化物对应的水化物反应
参考答案:BD
本题解析:由图中信息可知,X、Y、Z、W、R分别为O、Na、Al、S、Cl。因此原子半径的大小为:Y>Z>W>R>X,故选项A错误;对于选项C,WX3的化学式为SO3,和水反应后的化合物为H2SO4;不具备挥发性,因此错误。故答案为BD。
点评:本题此坐标图的形式考查了元素周期律,属于新型题型。对于元素周期律题目的解答,应首先判断出各个字母所代表的的元素,确定其元素符号,进而确定各种性质。
本题难度:简单
4、选择题 同族元素所形成的同一类型的化合物,其 结构和性质往往相似。化合物PH4I是一种白色晶体
结构和性质往往相似。化合物PH4I是一种白色晶体 ,下列对它的描述中正确的是
,下列对它的描述中正确的是
A.它是一种共价化合物
B.在加热时此化合物不能分解为PH3和HI
C.这种化合物不能跟碱反应
D.该化合物可以由PH3和 HI化合而成
HI化合而成
参考答案:D
本题解析:略
本题难度:一般
5、填空题 四种短周期非金属元素A、B、C、D原子序数依次增大。A是原子半径最小的元素,B原子的最外层电子数是次外层电子数的两倍,D在地壳中含量最大。请回答:
(1)B元素的原子结构示意图是 ?
(2)化合物CA3的电子式是 ,BD2分子的结构式为
(3)丙为含有上述四种元素的常见无机酸式盐,则丙的化学式为 。?
参考答案:(1)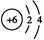 ? (2)
? (2)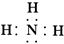 O
O C
C O (3)NH4HCO3
O (3)NH4HCO3
本题解析:A是原子半径最小的元素,则A是H元素;B原子的最外层电子数是次外层电子数的两倍,则B为C元素;D在地壳中含量最大,则D为O元素;A、B、C、D原子序数依次增大,则C为N元素。所以A、B、C、D分别为H、C、N、O。(2)CA3的化学式为NH3,BD2的化学式为CO2。(3)丙含有四种元素且是无机酸式盐,则丙应为碳酸氢铵,化学式为NH4HCO3。
本题难度:一般