时间:2020-07-08 01:40:01
1、选择题 下列说法正确的是 ( )
A.NaOH的摩尔质量是40g
B.1mol H2的质量与它的相对分子质量相等
C.1mol H2O的质量为18g /mol
D.氧气的摩尔质量在数值上等于它的相对分子质量
2、填空题 已知A、B两元素的单质气体在同温、同压下能以2∶1体积完全化合成C气体,且反应后的气体比反应前气体体积减少1/3。试证明B元素的单质气体一定不是单原子分子:______________________________________________________________。
3、选择题 向某二价金属M的M(OH)2的溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,洗涤、干燥后将沉淀置于足量的稀盐酸中,充分反应后,在标准状况下收集到V L气体。如要计算金属M的相对原子质量,你认为还必需提供下列哪项数据是?
A.M(OH)2溶液的物质的量浓度
B.与MCO3反应的盐酸的物质的量浓度
C.MCO3的质量
D.题给条件充足,不需要再补充数据
4、选择题 某同学为配置含有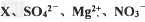 四种离子的无色溶液,要使四种离子的物质的量浓度之比为1:2:1:1,则X应该是
四种离子的无色溶液,要使四种离子的物质的量浓度之比为1:2:1:1,则X应该是
[? ]
A.?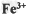 ?
?
B.?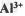 ?
?
C.?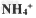 ?
?
D.? Cl-
5、选择题 将0.01 molNa2SO4·10H2O 溶于水中,要使Na+离子数目与水分子数目之比为1:100,则需加入水的质量为
A.18g
B.36g
C.34.2g
D.37.8g