时间:2020-07-08 01:39:39
1、填空题 A、B、C、D、E、F是原子序数依次递增的前四周期元素。其中A与D同主族、C与E同主族,且E的原子序数是C的两倍;A分别与B和C均可形成10电子分子;B与C的最外层电子数之比2∶3;F原子的最外层电子数与A相同,其余各层均充满;常见化合物D2C2与水反应生成C的单质,其溶液可使酚酞试液变红。据此回答下列问题:
(1)F元素形成的高价基态离子的核外电子排布式为?;C、D、E三元素原子均能形成简单离子,其离子半径大小顺序为?(用离子符号表示);
(2)A与C形成的10电子分子中含的化学键类型为?(填σ键或π键),分子中心原子的轨道杂化类型为?,其化合物晶体类型为?;化合物A2C和A2E中,沸点较高的是?(填分子式);
(3)向含1 mol A2E的水溶液中加入等物质的量的D2C2,有黄色沉淀生成,写出离子方程式?:
(4)常温常压下,有23 g液态化合物B2A6C与足量的C的单质充分反应,生成BC2气体和A2C液体,同时放出683.5 kJ的热量,该反应的热化学方程式为:?。
参考答案:
(1)? 1s22s22p63s23p63d9或[Ar]3d9? S2-> O2-> Na+ ?(各2分)
(2)σ键? sp3?分子晶体? H2O (各1分)
(3)? Na2O2 +H2S==2Na+ +2OH-?+S↓(3分)
(4)C2H6O(1) + 3O2(g) = 2CO2(g) + 3H2O(1)? ΔH =-1367.0 kJ·mol-1(3分)
本题解析:依题意可知:A为H,B为C,C为O,D为Na,E为S,F为Cu。O2-> Na+,氧离子与钠离子具有相同的核外电子排布,因为钠离子中的质子数比氧离子中的质子数多,所以吸引力强,半径就小。S2-> O2-氧和硫位于同一主族,从上到下,原子半径依次增大,那么相同电荷的阴离子的半径也是从上到下依次增大。向含1 mol A2E的水溶液中加入等物质的量的D2C2,有黄色沉淀生成,此黄色沉淀一定是硫单质。
本题难度:一般
2、选择题 下列化学用语表达正确的是( )
A.一氯乙烷的结构式CH3Cl
B.丁烷的结构简式CH3(CH2)2CH3
C.四氯化碳的电子式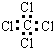
D.苯的分子式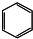
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列含有极性键的非极性分子是( )
(1)CCl4?(2)NH4?(3)CH4?(4)CO2?(5)N2
(6)H2S?(7)SO2?(8)CS2?(9)H2O?(10)HF.
A.(2)(3)(4)(5)(8)
B.(1)(3)(4)(5)(8)
C.(1)(3)(4)(8)
D.以上都不对
参考答案:(1)CCl4为正四面体结构,含有极性键,正负电荷的重心重合,电荷分布均匀,为非极性分子;?
(2)NH4+为正四面体结构,含有极性键,正负电荷的重心重合,电荷分布均匀,为非极性分子;
(3)CH4?为正四面体结构,含有极性键,正负电荷的重心重合,电荷分布均匀,为非极性分子;?
(4)CO2中有C、O元素之间形成极性键,且分子结构对称,正负电荷的中心重合,属于非极性分子;
(5)N2中只有N-N非极性键,属于非极性分子;
(6)H2S中有H、S元素之间形成极性键,分子结构不对称,正负电荷的中心不重合,属于极性分子;?
(7)SO2中有O、S元素之间形成极性键,分子结构不对称,正负电荷的中心不重合,属于极性分子;?
(8)CS2中有C、S元素之间形成极性键,且分子结构对称,正负电荷的中心重合,属于非极性分子;?
(9)H2O中H、O元素形成的极性键,但结构不对称,属于极性分子;?
(10)HF中H、F元素形成的极性键,但结构不对称,属于极性分子.
故选D.
本题解析:
本题难度:简单
4、选择题 某元素位于第三周期第VIA族.下列叙述不正确的是( )
A.该元素是非金属元素
B.该元素原子的核电荷数为16
C.该元素原子核外有3个电子层
D.该元素原子容易失去最外层电子
参考答案:某元素在周期表中位于第三周期VIA族,该元素原子核外有3个电子层,最外层电子数为6,核电荷数为16,是S元素,属于非金属元素,在反应中容易得电子.
A.S属于非金属元素,故A正确;
B.S是16号元素,其核电荷数等于原子序数为16,故B正确;
C.硫元素核外有3个电子层,最外层电子数为6,故C正确;
D.硫元素最外层有6个电子,在反应中容易得2个电子使最外层达到8电子稳定结构,故D错误;
故选D.
本题解析:
本题难度:一般
5、选择题 下列说法正确的是
[? ]
A.含有金属阳离子的晶体一定是离子晶体
B.只有在原子中,质子数才与电子数相等
C.非金属元素组成的化合物,一定是共价化合物
D.液态氯化氢不导电
参考答案:D
本题解析:
本题难度:简单