时间:2020-07-08 01:36:07
1、填空题 环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮: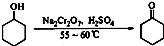
环己醇、环己酮和水的部分物理性质见下表:
| 物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)★ | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95)★ | 0.9478 | 微溶于水 |
| 水 | 100.0 | 0.9982 | ? |
参考答案:(1)①缓慢滴加?②环己酮和水形成具有固定组成的混合物一起被蒸出
(2)①c d b a?②漏斗、分液漏斗?③增加水层的密度,有利于分层
(3)3
本题解析:(1)①由于酸性Na2Cr2O7溶液氧化环己醇反应剧烈,导致体系温度迅速上升、副
反应增多,所以酸性Na2Cr2O7溶液加入不能太快,应用酸式滴定管缓慢滴加。
②环己酮和水能形成具有固定组成的混合物,具有固定的沸点,蒸馏时能被
一起蒸出,所以蒸馏难以分离环己酮和水的混合物。
(2)①见答案?②根据操作过程找出还需要的玻璃仪器有漏斗、分液漏斗。
③联系制取肥皂的盐析原理,即增加水层的密度,有利于分层。
(3)因为环己酮的结构简式为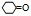 ,所以环己酮分子中有3种不同化学环境的氢原子。
,所以环己酮分子中有3种不同化学环境的氢原子。
本题难度:一般
2、填空题 ( 12 分)(1)某校化学兴趣小组用如下图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:
①写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:
?
??。
②溶液a中存在的阴离子有__________________;在溶液a中加入盐酸时需控制溶液的pH的原因是_______________________________________;为此,改进方法是?。
?(2)?该化学小组又测定一定质量的某镁铝混合物中镁的质量分数,设计了如下实验方案:
方案Ⅰ:镁铝混合物 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:镁铝混合物 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是??(填代号)
A.溶液A选用NaOH溶液
B.若溶液B选用浓硝酸,则测得镁的质量分数偏小
C.溶液A和B均可选用稀硝酸
D.实验室中方案Ⅱ更便于实施
参考答案:(1)①Mg2++2OH-===Mg(OH)2↓? Al3++3OH-===Al(OH)3↓
Al(OH)3+OH-===AlO2—+2H2O?②Cl-、AlO2—、OH-?
因为氢氧化铝能与强酸反应,所以在加入盐酸沉淀AlO2—时,需要控制溶液
的pH,以防止部分氢氧化铝转化成Al3+;通入过量二氧化碳气体?(2)C
本题解析:略
本题难度:一般
3、选择题 下列物质除杂(括号内物质为杂质)所用试剂正确的是( )
| 物质 | 试剂] A Na2SO4溶液(NaBr) Cl2 B FeCl2溶液(FeCl3) Cu C Cl2(HCl) 饱和食盐水 D CO2(HCl) 饱和Na2CO3溶液 |
参考答案:A.发生2NaBr+Cl2=2NaCl+Br2,生成NaCl,引入新杂质,故A错误;
B.生成CuCl2,引入新杂质,应用Fe除杂,故B错误;
C.Cl2不溶于饱和食盐水,可用饱和食盐水除杂,故C正确;
D.CO2和HCl都可与饱和Na2CO3溶液反应,应用饱和碳酸氢钠溶液除杂,故D错误.
故选C.
本题解析:
本题难度:一般
4、选择题 下列有关除杂质(括号中为杂质)的操作中,错误的是
[? ]
A.福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物
B.溴乙烷(乙醇):多次加水振荡,分液,弃水层
C.苯(苯酚):加溴水,振荡,过滤除去沉淀
D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列物质的提纯或离子检验的方法正确的是?
A.用渗析的方法精制氢氧化铁胶体
B.以精铜为阳极,粗铜为阴极,CuSO4溶液为电解液精炼铜
C.除去KCl溶液中的少量MgCl2,加入过量KOH溶液,然后过滤即可
D.加入澄清石灰水,能产生白色沉淀,则原溶液中一定含有CO32—
参考答案:A
本题解析:胶体不能透过半透膜,而溶液可以透过半透膜,利用渗析可以精制胶体,A正确;以粗铜为阳极,精通为阴极,CuSO4溶液为电解液精炼铜,选项B不正确;C不正确,过滤后还要加入适量的盐酸酸化;D不正确,因为能和澄清石灰水反应的不止碳酸盐,还可以是碳酸氢盐,答案选A。
点评:在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
本题难度:一般