时间:2020-07-08 01:36:07
1、实验题 亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
已知:室温下,①2NO+Na2O2→2NaNO2?②3NaNO2+3HCl→3NaCl+HNO3+2NO↑+H2O;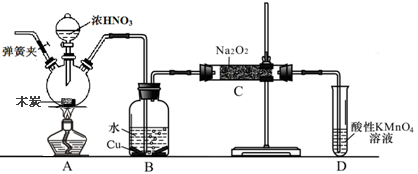
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式?。
(2)B中观察到的主要现象是?,D装置的作用是?。
(3)检验C中产物有亚硝酸钠的方法是?。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和?,为避免产生这些副产物应在B、C装置间增加装置E,画出E并注明E中盛放的药品名称?。
(5)写出检验C产物中是否含碳酸钠的方法?。
(6)将1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭?g。
参考答案:(1)C+4HNO3(浓)=加热=CO2+4NO2+2H2O
(2)铜片逐渐溶解,溶液变为蓝色,有无色气体产生?吸收未反应的NO
(3)取样,加入稀盐酸,产生无色气体,遇到空气变为红棕色
(4)氢氧化钠 干燥管 碱石灰
(5)取样,加入酸性高锰酸钾溶液,若有使澄清石灰水变浑浊的气体产生,则有碳酸钠
(6)0.36g(关系式法C~4NO2~4/3 NO~2/3 Na2O2 )
本题解析:(1)写出浓硝酸与木炭在加热条件下发生氧化还原反应的化学方程式C+4HNO3(浓)=加热=CO2+4NO2+2H2O。
(2)A中生成的二氧化氮进入B中并与水反应,生成了硝酸,硝酸和铜反应,观察到的主要现象是铜片逐渐溶解,溶液变为蓝色,有无色气体产生,由于一氧化氮有毒,D装置的作用是吸收未反应的NO。
(3)检验C中产物有亚硝酸钠的方法是取样,加入稀盐酸,产生无色气体,遇到空气变为红棕色。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,氢氧化钠是由水和过氧化钠生成,为避免产生这些副产物应在B、C装置间增加干燥装置E,药品名称碱石灰放在干燥管中。
(5)检验碳酸根的方法:取样,加入酸性高锰酸钾溶液,若有使澄清石灰水变浑浊的气体产生,则有碳酸钠。
(6)将1.56g过氧化钠是0.02mol,完全转化成为亚硝酸钠,根据①2NO+Na2O2→2NaNO2,生成NaNO2 0.04mol,C+4HNO3(浓)=CO2+4NO2+2H2O,3NO2+2H2O=2HNO3 + NO +H2O,得出关系式1.5C---2NaNO2,可求得碳的物质的量为0.03mol,理论上至少需要木炭0.36g。
本题难度:一般
2、填空题 (8分)提纯下列物质(括号内为杂质),填写所选用的除杂试剂和除杂方法
| ? | 括号内为杂质 | 除杂试剂 | 操作 |
| 1 | 乙烷(乙烯) | ? | ? |
| 2 | 乙酸乙酯(乙酸) | ? | ? |
| 3 | 苯(苯酚) | ? | ? |
| 4 | 乙醇(水) | ? | ? |
参考答案:(共8分)(每空1分)
?
括号内为杂质
除杂试剂
操作
1
乙烷(乙烯)
溴水
洗气
2
乙酸乙酯(乙酸)
饱和Na2CO3溶液
分液
3
苯(苯酚)
NaOH溶液
分液
4
乙醇(水)
新制CaO
蒸馏
本题解析:略
本题难度:简单
3、选择题
A.可以用分液漏斗分离甘油和水的混合物
B.除去CO2中的少量CO可以通入O2后点燃
C.不用任何其它试剂就可以鉴别NaOH溶液和Al2(SO4)3溶液
D.检验溴乙烷中的溴元素,可以加入氢氧化钠溶液煮沸,冷却后再加入硝酸银溶液
参考答案:C
本题解析:本题考查内容涉及混合物的分离,物质的鉴别,中等难度题。甘油和水互溶,A错误。CO属可燃性气体,混合气体直接点燃,极易发生爆炸,存在安全隐患,B错误。根据NaOH溶液和Al2(SO4)3溶液滴加方向不同,发生反应的现象不同即可将两者分离,C正确。检验溴乙烷中溴元素,加入硝酸银溶液之前必须加过量硝酸中和溶液中剩余的NaOH溶液,故D错误。
本题难度:一般
4、选择题 下列实验做法不正确的是
A.用无水硫酸铜检验乙醇中是否含水
B.用溴水检验汽油中是否含有不饱和脂肪烃
C.用蒸馏的方法可以分离醋酸与乙醇的混合物
D.检验某卤代烃中是否含溴:加入NaOH溶液,加热,冷却,再加入硝酸银溶液
参考答案:CD
本题解析:A、无水硫酸铜遇水变成蓝色,正确;B、不饱和烃,能使溴水褪色,正确;C、醋酸和乙醇在加热时,部分生成乙酸乙酯,错误;D、“加入NaOH溶液,加热”为卤代烃发生水解取代反应,有溴离子,但若没有酸化直接加入硝酸银,则生成的沉淀可能为氢氧化银等。
本题难度:一般
5、选择题 下列实验操作中有错误的是( )
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.实验室制取蒸馏水的装置中,温度计水银球应与蒸馏烧瓶的支管口在同一水平线
C.用淘洗的方法从沙里淘金
D.用蒸发方法使NaCl从溶液中析出时,应边加热边搅拌直至溶液蒸干
参考答案:A.分液时应防止液体重新混合而污染,则应下层液体从下口放出,上层液体从上口倒出,故A正确;
B.蒸馏时,测量的是馏分的温度,所以温度计水银球应与蒸馏烧瓶的支管口在同一水平线,故B正确;
C.金和沙子的密度不同,可用淘洗法分离,故C正确;
D.蒸发时,不能直接将溶液蒸干,当有大量晶体析出时,停止加热,用余热蒸干,故D错误.
故选D.
本题解析:
本题难度:一般