时间:2020-07-08 01:23:36
1、选择题 下列关于热化学反应的描述中正确的是
[? ]
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283. 0kJ/mol,则2CO2(g)=2CO(g)+O2(g) 反应的△H =2×283.0kJ/mol
C.△H>0,△S>0,在任何温度下都不可自发进行。
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
参考答案:B
本题解析:
本题难度:简单
2、选择题 从环境保护角度分析,人类最理想的能源是
参考答案:
本题解析:
本题难度:简单
3、选择题 用0.102 6 mol·L-1的盐酸滴定25.00 mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为( )
A.22.30 mL
B.22.35 mL
C.23.65 mL
D.23.70 mL
参考答案:B
本题解析:图中液面在22~23 mL之间,分刻度有10个,因而每刻度是0.1 mL,液体的凹面读数约为22.35 mL。
本题难度:一般
4、实验题 (12分)如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题: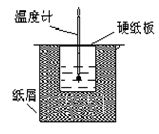
(1)从实验装置上看,图中伤缺少的一种玻璃仪器是_____________;
(2)烧杯间填满碎纸条的作用是____________________;
(3)若大烧杯上不盖硬纸板,求得的反应热数值__________(填“偏大”“偏小”或“无影响”)。
(4)实验中该用60 mL 0.50 mol·L-1HCl跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热__________(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会________(填“偏大”“偏小”或“无影响”)。
参考答案:(12分)(1)环形玻璃搅拌棒? (2)减少实验过程中的热量损失
(3)偏小? (4)不相等;相等;(5)偏小
本题解析:(1)在实验过程中,需要搅拌,所以还缺少环形玻璃搅拌棒。
(2)由于在实验过程中,需要尽可能的减少热量的损失,因此烧杯间填满碎纸条的作用是减少实验过程中的热量损失。
(3)若大烧杯上不盖硬纸板,则会导致热量的损失,因此求得的反应热数值偏小。
(4)改变酸或碱的用量,可以改变反应中放出的热量,但不能改变中和热,因为中和热是在一定条件下,稀溶液中酸和碱反应生成1mol水时放出的热量,因此中和热时不变的。
(5)由于氨水中存在电离平衡,而电离是吸热的,所以测得的中和热数值会减小。
本题难度:一般
5、选择题 下列说法正确的
[? ]
A.△H>0表示反应放热,△H<0表示反应吸热
B.热化学方程式中的化学计量数表示物质的量,可以是分数
C.1molH2SO4与1molBa(OH)2反应生成BaSO4沉淀时释放出的热叫中和热
D.1molH2和0.5molO2反应放出的热就是H2的燃烧热
参考答案:B
本题解析:
本题难度:简单