时间:2020-07-08 01:23:36
1、选择题 25℃时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L HA酸溶液,溶液pH变化曲线如下图所示,仔细观察下图,判断有关说法中不正确的是(? )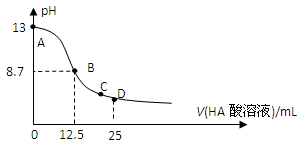
A.HA酸是弱酸
B.当滴定过程中溶液pH=7时,c(Na+)=c(A-)>c(OH-)=c(H+)
C.在C点:c(Na+)>c(A-)>c(H+)>c(OH-)?
D.在D点:c(A-)+c(HA)=2c(Na+)
2、选择题 25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是
A.c(NH4+)=c(SO42-)
B.c(NH4+)>c(SO42-)
C.c(NH4+)<c(SO42-)
D.c(OH-)+c(SO42-) = c(NH4+)+c(H+)
3、选择题 有关下列溶液的叙述正确的是
A.醋酸与醋酸钠的混合溶液中:c(CH3COO-)+ c(OH-) = c(Na+) + c(H+)
B.1 mol·L-1Na2CO3溶液中:c(OH-) = c((H+) + c(HCO3-) + c(H2CO3)
C.0.1 mol·L-1的硫酸铵溶液中:c(SO42-) >c(NH4+)>c(H+)> c(OH-)
D.将1molKCl、1molNaHS溶于水配成1L混合溶液中:
n(K+) = n(S2-)+n(HS-)+n(H2S) = 1mol
4、选择题 在由水电离出的c(OH-)=1.0×10-14 mol·L-1的溶液中可能大量共存的离子组为(?)
A.Fe2+、K+、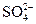 、
、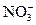
B.Na+、K+、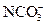 、Cl-
、Cl-
C.Na+、K+、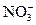 、
、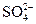
D.K+、Na+、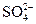 、Cl-
、Cl-
5、实验题 (1)常温下,0.1 mol/L的醋酸和0.1 mol/L的盐酸各100 mL,分别与足量的锌粒反应,产生的气体体积前者?后者(填“<”、“>”或“=”).
(2)在25℃条件下将pH=5的氯化铵溶液稀释100倍 ,稀释后溶液的pH为(填选项字母,下同)?.
,稀释后溶液的pH为(填选项字母,下同)?.
A.5? B.7 ?C.3~5之间? D.5~7之间
(3)将体积和物质的量浓度都相同的醋酸和氢氧化钠溶液混合后,溶液呈?性(填“酸”,“中”或“碱”,下同),溶液中c(Na+)?c(CH3COO-)(填“ >” 或“=”或“<”,下同 )。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈?性,溶液中c(Na+)?c(CH3COO-)
(5)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)?氢氧化钠溶液中c(OH-),m与n的大小关系是m?n。
(6)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是?。(多选、错选不得分)
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质;
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
E.未用标准液润洗碱式滴定管。