时间:2020-07-08 01:18:57
1、计算题 把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58克白色沉淀,在所得的浊液中逐渐加入0.5mol/L盐酸,加入盐酸的体积与生成沉淀的质量关系如下图所示 。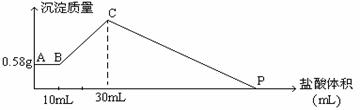
回答下列问题:
①混合物中NaOH质量为 ; ②混合物中AlCl3的物质的量为 ;
③混合物中MgCl2的物质的量为 ;④P点所示的盐酸体积为 。
2、填空题 有五种物质是①6 g H2②0.5 mol CO2③1.204×10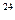 个氯化氢分子④147 g硫酸
个氯化氢分子④147 g硫酸
⑤92 g乙醇(C2H5OH),它们的物质的量最大的是 ,所含分子数最多的是 ,含有原子个数最多的是 ,质量最大的是 。
3、选择题 配制一定物质的量浓度的某溶液,下列情况,会使配制结果偏高的是
[? ]
A.未冷却即转移、定容
B.未洗涤烧杯和玻璃棒
C.定容时仰视刻度线观察液面
D.容量瓶中原来含有少量蒸馏水
4、选择题 0.5L 1molL-1?FeCl3溶液与0.1L 1 molL-1 MgCl2溶液中Cl-的数目之比(? )
A 5 :2 B3 :1 C ?15 : 2 D1 :3
5、选择题 设NA为阿伏伽德罗常数的数值。下列说法正确的是
A.1mol甲苯含有6NA个C-H键
B.18gH2O含有10NA个质子
C.标准状况下,22.4L氨水含有NA个NH3分子
D.56g铁片投入足量浓硫酸中生成NA个SO2分子