时间:2020-07-08 01:18:57
1、选择题 NA代表阿伏加德罗常数,下列有关叙述正确的是( )
A.标准状况下,2.24 L CH2Cl2中含有 C—H 键数为 0.2 NA
B.常温下,100 mL 1 mol?L-1 Na2CO3溶液中阴离子总数大于 0.1 NA
C.分子数为NA的 CO、C2H4混合气体体积约为 22.4 L,其质量为 28 g
D.3.4 g NH3中含 N—H 键数目为 0.2 NA
参考答案:B
本题解析:A项CH2Cl2是液体,不能用22.4L表示体积,C项,没有标明温度和压强,D项1个NH3分子中含有3个N—H,3.4 g NH3中含有0.6NA。答案选B。
考点:阿伏伽德罗常数
点评:阿伏伽德罗常数是历年高考的“热点”问题。多年来全国高考化学试题出现的几率为100%。这双因为它既考查了学生对物质的量与粒子数、质量、气体体积和物质的量浓度之间的关系,又可以与物质结构、盐类水解、弱电解质的电离等其他的概念性知识点结合成综合性习题。
本题难度:困难
2、选择题 需要配制2mol/L的NaCl溶液950mL,应选用的容量瓶的规格和称取的NaCl质量分别是
A.1000mL,117g
B.500mL,117g
C.950mL,111.2g
D.任意规格,111.2g
参考答案:A
本题解析:实验室没有950mL的容量瓶,应用1000mL的容量瓶进行配制,则n(NaCl)=1L×2mol/L=2mol,m(NaCl)=2mol×58.5g/mol=117g,选A。
考点:考查一定物质的量溶液的配制。
本题难度:一般
3、简答题 化学--选修2:化学与技术
KMnO4是一种常用的强氧化剂,工业上以软锰矿(主要成分MnO2)为原料,通过液相法生产.即在反应器中碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再在电解槽中用铂板作用阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示: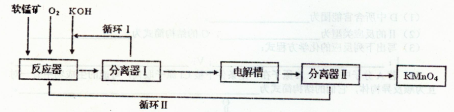
回答下列问题:
(1)写出反应器中反应的方程式______
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量较低的贫矿中Al的氧化物含量较高,会导致KOH消耗量偏离,用离子方程式表示KOH消耗偏高的原因______.
(3)写出电解槽中阴极和阳极的电极反应方程式阴极:______阳极:______.
(4)在传统工艺中,得到K2MnO4后,向其溶液中避入CO2制备KMnO4,配平方程式:K2MnO4+CO2=KMnO4+MnO2+K2CO3将所得到的KMnO4配成0.1mol?L-1 KMnO4溶液,滴定20.00mL未知浓度的FeCl2液,消耗KMnO4溶液30.00mL.滴定达到终点时的现象为:______,则FeCl2溶液的浓度为______mol/L.
参考答案:(1)二氧化锰和氢氧化钾、氧气发生生成锰酸钾和水,反应的化学方程式为4KOH+2MnO2+O2=2K2MnO4+2H2O,
故答案为:4KOH+2MnO2+O2=2K2MnO4+2H2O;
(2)氧化铝是两性氧化物,既能与强酸反应也能与强碱反应,所以氧化铝和强碱反应生成偏铝酸盐和水,反应的离子方程式为2OH-+Al2O3=2AlO2-+H2O,
故答案为:2OH-+Al2O3=2AlO2-+H2O;
(3)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-=H2↑+2OH-,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-=2MnO4-,
故答案为:阴极:2H2O+2e-=H2↑+2OH-,阳极:2MnO42--2e-=2MnO4-;
(4)氯化亚铁有还原性,高锰酸钾有强氧化性,所以氯化亚铁能被高锰酸钾氧化成氯化铁,故滴定达到终点时的现象为:溶液从浅绿色变为紫红色并且在30秒内不褪色;
设氯化亚铁溶液的浓度为C.
5Fe2++8H++MnO4-=5Fe3++Mn2++4H2O
5mol? 1mol
0.02Cmol? 0.003mol
C=0.75mol?L-1
故答案为:溶液从浅绿色变为紫红色并且在30秒内不褪色;0.75.
本题解析:
本题难度:一般
4、填空题 (8分)H2SO4的摩尔质量是 ,196g H2SO4的物质的量是 ,其中含有 g O和 molH。
参考答案:98g/L 2mol 128 4
本题解析:如果质量的单位用g表示,则摩尔质量在数值上等于物质的相对分子质量或相对原子质量,所以硫酸的摩尔质量是98g/mol。根据n=m/M可知,196g硫酸的物质的量是196g÷98g/mol=2mol。根据硫酸的化学式可知,含有2mol×2=4mol氢原子和2mol×4mol=8mol氧原子,则氧原子的质量是16g/mol×8mol=128g。
考点:考查物质的量的有关计算
点评:在进行物质的量的有关计算时,关键是熟练应用几个关系式 、n=m/M、
、n=m/M、 、
、 等。
等。
本题难度:一般
5、填空题 硝酸具有强的氧化性,并且浓度不同,氧化能力也不同。
(1)质量分数为63%,密度为?1.5?g·cm-3的浓硝酸,其物质的量浓度为___________。
(2)某学习小组为比较浓、稀硝酸分别与铜反应的不同,需配制100mL?3?mol·L-1稀硝酸,他们需要量取上述浓硝酸___________mL;如下图所示仪器,在配制过程中不需用到的是_____________(填序号)。 ? ?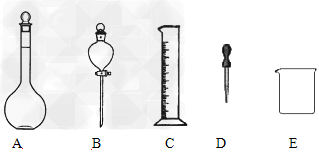
除图中已有的仪器外,配制上述溶液还需用到的玻璃仪器是__________;
参考答案:(1)15?mol·L-1?
(2)20.0mL;B;玻璃棒
本题解析:
本题难度:一般