时间:2020-07-08 01:14:56
1、填空题 现有常见金属单质A和气体甲、乙及物质B、C、D、E、F,它们之间能发生如下反应,已知B加入硫氰化钾溶液显血红色,气体乙显红棕色,(图中有些反应的产物和反应的条件没有全部标出).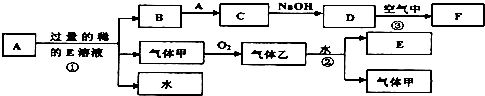
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A______,C______
(2)写出反应①的化学方程式______;
(3)写出反应②的化学方程式______;
(4)B物质的阳离子用于制作印刷电路板的原理是(用离子方程式表示)______
(5)缺铁性贫血患者应补充C物质的阳离子,而B物质的阳离子则无这种药效.当用C物质的阳离子制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是______如果药片已经失效,应如何检验?写出主要操作与现象:______.
参考答案:依据转化关系分析可知,已知B加入硫氰化钾溶液显血红色,证明含铁离子,气体乙显红棕色证明为NO2,气体甲为NO,E为HNO3,金属单质A为Fe;B为Fe(NO3)3,C为Fe(NO3)2,D为Fe(OH)2,F为Fe(OH)3;
(1)A、C的化学式分别为:Fe、Fe(NO3)2,故答案为:Fe;Fe(NO3)2;
(2)反应①是铁和稀硝酸反应生成硝酸铁、一氧化氮和水的反应,反应的化学方程式为:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,
故答案为:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O;
(3)反应②是二氧化氮和水的反应,反应的化学方程式为:3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(4)B为Fe(NO3)2物质的阳离子为Fe3+用于制作印刷电路板的原理是铁离子和铜反应,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(5)铁性贫血患者应补充C物质的阳离子,而B物质的阳离子则无这种药效.当用C物质的阳离子制成药片时外表包有一层特殊的糖衣,亚铁离子具有还原性,易被氧化,糖衣是为了避免亚铁离子被氧化;如果药片已经失效可以根据铁离子检验方法进行检验,FeSO4易被空气中的氧气氧化,被氧化生成Fe3+离子,可用KSCN溶液检验,实验操作为取少量研碎的药片放入试管中,加适量的水溶解,然后滴加数滴KSCN溶液,反应后溶液显红色,则表明该药片已部分或全部失效,
故答案为:保护FeSO4不被空气中的氧气氧化;取少量研碎的药片放入试管中,加适量的水溶解,然后滴加数滴KSCN溶液,反应后溶液显红色,则表明该药片已部分或全部失效.
本题解析:
本题难度:一般
2、选择题 (14分)中学化学常见的物质A、B、C、D之间存在如下转化关系:
A + B → C + D + H2O。请按要求填空:
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体,
C、D两种气体均能使澄清石灰水变浑浊,则A与B反应的方程式是?,已知具有刺激性气味的C气体和Cl2都能漂白某些有色物质,如果将两种气体等物质的量通入到品红溶液中的实验现象为?原因是?。
如果将两种气体非等量通入到水中,为了验证哪种气体过量,某兴趣小组的同学准备了以下试剂: ① 氯化铁溶液? ② 氯化亚铁溶液? ③ 硫氰化钾溶液? ④ 苯酚溶液
⑤ 品红溶液? ⑥ 酸性高锰酸钾溶液
若Cl2过量:取适量溶液滴加至盛有?(选填一个序号)试剂的试管内,再加入
?(选填一个序号)试剂,发生的现象是:?;
若C过量:取适量溶液滴加至盛有?(选填一个序号)试剂的试管内,发生的现象
是:?。
(2)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质;C是漂白粉的有效成分,则C发生水解反应的离子方程式是?。
(3)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体。检验A中阳离子的方法是?
?(简述操作过程及结论)。
参考答案:(1)C + 2H2SO4(浓) 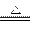 ?CO2↑+2SO2↑+2H2O?(2分)
?CO2↑+2SO2↑+2H2O?(2分)
无现象(1分);Cl2+SO2+2H2O=4H++2Cl―+SO42―,失去漂白性(2分)
②(1分)?③(或④)(1分)?溶液呈现红色(或紫色)(1分)
⑤(或⑥)(1分)?红色褪去(紫红色褪去)(1分)
(2)ClO-+ H2O  ?HClO + OH-?(2分)
?HClO + OH-?(2分)
(3)取少量A溶于水配成溶液于试管中,向该溶液中加入NaOH并加热,用湿润的红色石蕊试纸放于管口检验生成气体,石蕊试纸变蓝证明溶液中含有NH4+。?(或用浓盐酸检验,有白烟生成)?(2分)
本题解析:略
本题难度:简单
3、简答题 已知A、B、C、D为气体,其中A呈黄绿色,D极易溶于水,形成的溶液可使酚酞变红.它们之间的转化关系如图1所示: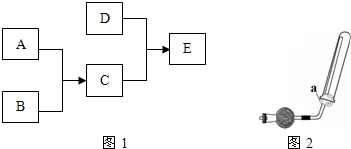
(1)将B点燃,把导管伸入盛满A气体的集气瓶,可以观察到的实验现象有(填序号)______.
①放热②黄绿色褪去 ③瓶口有白烟
④瓶口有白雾⑤安静燃烧,发出黄色火焰⑥安静燃烧,发出苍白色火焰
(2)实验室制D的化学方程式为______.
(3)实验室可用如图2所示装置收集D,下列叙述正确的______(填序号).
①D气体不能用排水法收集 ②干燥管里盛有碱石灰 ③右图中的a为浸有稀H2SO4的棉花
(4)工业生产D的化学方程式是______.
(5)检验E中阳离子的方法是:取少量E于试管中,______.
参考答案:A为黄绿色气体,应为Cl2,D极易溶于水,形成的溶液可使酚酞变红,应为NH3,则C应为HCl,B为H2,则E为NH4Cl,
(1)B为H2,在氯气中燃烧时生成HCl,因HCl易溶于水,则可观察到有白雾生成,反应放热,黄绿色褪去,发出苍白色火焰等现象,
故答案为:①②④⑥;
(2)实验室用氢氧化钙和氯化铵反应制备氨气,反应的方程式为Ca(OH)2+2NH4Cl△. CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl△.CaCl2+2NH3↑+2H2O;
(3)氨气易溶于水,具有碱性,与硫酸反应,密度比空气小,可用向下排空法收集,故答案为:①②;
(4)工业生产NH3的化学方程式是N2+3H2高温、高压
本题解析:
本题难度:简单
4、填空题 有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1)若②、⑦、⑧三种元素在周期表中相对位置如下
| ② | ? | ? | ? |
| ? | ? | ⑦ | ⑧ |
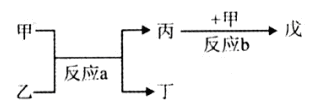
参考答案:(1)第三周期第ⅥA;(2分)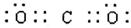 (1分)
(1分)
共价键(1分)H2CO3、H2SO4、HClO4;(1分)S2―>Cl―(1分)
(2)①4NH3+5O2 4NO+6H2O(2分)
4NO+6H2O(2分)
②3NO2+H2O=2HNO3+NO(2分)
(3)?①Cu2++2e―=Cu(2分)
②2Al+Fe2O3 2Fe+Al2O3(2分)
2Fe+Al2O3(2分)
本题解析:(1)②的原子序数不可能是1,由②在周期表中的位置可知,②处于第二周期,⑦⑧处于第三周期,②与⑦形成的液体化合物是常见的重要溶剂,该化合物为SC2或CCl4,由②⑦⑧的位置可知,②为碳,⑦为硫,⑧为氯,②与⑧形成的液体化合物为CCl4,S原子原子有3个电子层,最外层电子数为6,处于周期表中第三周期第ⅥA族;二氧化碳分子中碳原子与氧原子之间形成2对共用电子对,电子式为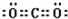 ;CCl4中碳原子与离子之间形成1对共用电子对,为共价键;非金属性C<S<Cl,最高价氧化物对应水化物的酸性强弱的顺序是HClO4>H2SO4>H2CO3;S2-、Cl-电子层结构相同,核电荷数越大离子半径越小,故离子半径S2->Cl-,答案为:第三周期第ⅥA族;;共价键;HClO4>H2SO4>H2CO3;S2->Cl-;
;CCl4中碳原子与离子之间形成1对共用电子对,为共价键;非金属性C<S<Cl,最高价氧化物对应水化物的酸性强弱的顺序是HClO4>H2SO4>H2CO3;S2-、Cl-电子层结构相同,核电荷数越大离子半径越小,故离子半径S2->Cl-,答案为:第三周期第ⅥA族;;共价键;HClO4>H2SO4>H2CO3;S2->Cl-;
(2)戊为红棕色气体,则戊为NO2,反应b为NO+O2→NO2,由反应a可知,甲与乙反应生成丙,故甲为O2,故丙为NO,反应a为NH3+O2→NO+H2O,乙为NH3,丁为H2O,
①反应a的化学方程式为:4NH3+5O2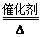 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2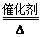 4NO+6H2O;
4NO+6H2O;
②NO2与H2O反应生成HNO3、NO,反应方程式为:3NO2+H2O=2HNO3+NO↑,故答案为:3NO2+H2O=2HNO3+NO↑;
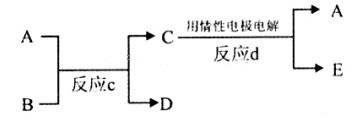
(3)①A是红色金属单质,A为Cu,E是具有黄绿色的气体,则E为Cl2,反应d中阴极发生还原反应,是铜离子放电生成Cu,反应d中阴极电极反应式为:Cu2++2e-═Cu,
故答案为:Cu2++2e-═Cu;
②若反应c是在高温下进行的,物质C是一种两性化合物,为Al2O3,其中B是暗红色固体,为Fe2O3,反应c为铝热反应,A为Al、D为Fe、E为O2,反应c的方程式为:Fe2O3+2Al 2Fe+Al2O3,故答案为:Fe2O3+2Al
2Fe+Al2O3,故答案为:Fe2O3+2Al 2Fe+Al2O3.
2Fe+Al2O3.
本题难度:一般
5、填空题 (6分)下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,A为日常生活中常见的金属单质, G为黄绿色气体,F是海水中含有盐的主要成分,J为D、G反应产物形成的水溶液。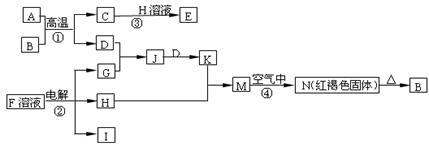
请回答下列问题:
(1)H的化学式为_______________。(2)反应②在工业上通常称之为__________工业。
(3)写出反应③的离子方程式?。
(4)写出反应②的化学方程式?。
参考答案:(6分)(1)NaOH? (2)氯碱工业
(3)Al2O3+2OH- =2AlO2-+H2O? 2NaCl+2H2O=2NaOH+H2+Cl2
本题解析:略
本题难度:一般