时间:2020-07-08 01:14:56
1、填空题 (16分)某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去)。已知①图中每个小三角形的三种物质中至少含有一种相同元素,K与L、A与B分别含有相同的元素。②D,J为固体单质,R为气体单质,其余为常见化合物。③A能使品红溶液褪色,也能使澄清石灰水变浑浊。④E为淡黄色化合物,E与C或L反应都能生成R。⑤I为氧化物,I与F或C都能反应;G和L反应生成难溶物H,H具有较强的吸附性。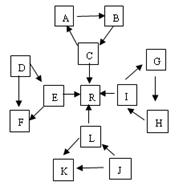 ?
?
(1) J物质的化学式为??,B所形成的晶体
为?晶体,工业上要让B转化为C,与B反应的原料是?。
(2)标况下,由E生成R? 11.2 L时转移的电子数为?。
(3)C+J A+L的化学方程式为:?。
A+L的化学方程式为:?。
I+F→G的离子方程式为:? ?。
?。
(4)常温下,测得一定浓度的G溶液的pH=10,试用离子方程式表示其原因 ?。
?。
(5)J的最简单氢化物可与空气在碱性溶液中形成燃料电池,其负极电极反应式为?。
2、推断题 有关FeSO4的转化关系如下图所示(无关物质已略去)。 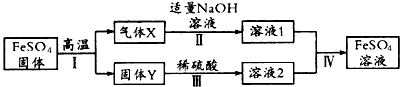
已知:①高温下X气体由两种常见含硫的氧化物组成。
②NaOH溶液与气体X恰好完全反应,生成两种常见的正盐。
③Y是红棕色的化合物。
(1)气体X的成分是(填化学式)________。
(2)反应I的反应类型属于(填序号)___________。
a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应
(3)溶液1中含氧酸根离子的检验方法是________________。
(4)若经反应I得到16 g固体Y,产生的气体X恰好被 0.4 L 1 mol/L NaOH溶液完全吸收生成正盐,则反应Ⅳ 中生成FeSO4的离子反应方程式是_____________________。
3、简答题 已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应呈黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃.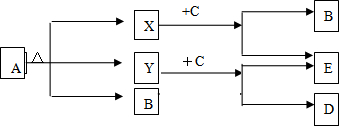
(1)写出下列物质的化学式:A______B______?C______?D______?E______
(2)写出A受热分解的化学方程式:______.
4、推断题 A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y 的单质是生活中常见的金属,相关物质间的关系如下图所示。 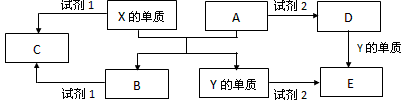
(1)X的单质与A反应的化学方程式是___________ 。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是____________ 。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是___________ 。
②将物质C溶于水,其溶液呈酸性,原因是______________(用离子方程式表示) 。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是________________ 。
5、选择题 A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属,D、E、F是常见的三种氧化物,且有如图所示转化关系,则下列说法不正确的是( )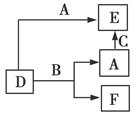
A.D、E中一定都含有甲元素
B.单质B肯定是氧化剂
C.A、B、C中一定有一种是氧元素的单质
D.若A是非金属,则B一定为金属