时间:2020-07-08 01:09:10
1、填空题 (9分)某硫酸厂周围的空气含有较多二氧化硫,为了测定空气中二氧化硫的体积分数做了如下实验:
取上述标准状况下的空气1L(内含N2、O2、SO2、CO2)慢慢通过足量氯水,然后在此溶液中加入过量的BaCl2溶液,产生白色沉淀,将沉淀洗净、干燥后称重为0.466g。
(1)此空气中SO2的体积分数为多少(写清楚具体的计算过程)
(2)若将上述标准状况下的空气1L慢慢通过足量硫化氢水溶液,将析出沉淀的质量是多少?
2、填空题 从某物质A的水溶液出发有下图所示的一系列变化:?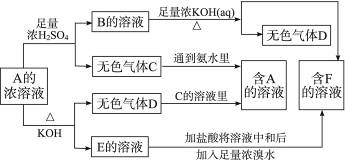
试完成下列问题:?
(1)物质的化学式:A____________,B____________,C____________,D____________,E____________,F____________。?
(2)写出EF的离子方程式________________________。?
(3)鉴定物质F的方法________________________。?
3、填空题 (7分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就三大酸与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解。该反应的化学方程式为:__________________________________。
(2)在一定体积的18 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为______________。
(3)根据下图操作及现象推断酸X为_______(填序号)。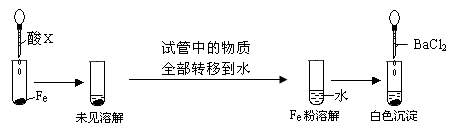 ?
?
a.浓盐酸? b.浓硫酸?c.浓硝酸?
4、实验题 某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了下图所示装置进行有关实验:
(1)先关闭活塞a,将6.4 g铜片和10 mL 18 mol/L的浓硫酸放在圆底烧瓶中共热至反应完成,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中圆底烧瓶内发生反应的化学方程式:
打开活塞a之前___________________________________________________;
打开活塞a之后___________________________________________________。
②B是用来收集实验中产生的气体的装置,但集气瓶内的导管未画全,请直接在图上把导管补充完整。
(2)实际上,在打开活塞a之前硫酸仍有剩余。为定量测定余酸的物质的量,甲、乙两学生进行了如下设计:
①甲学生设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量。他测定SO2的方法是将装置A产生的气体缓缓通过装置D,从而测出装置A产生气体的体积(已折算成标准状况下)。你认为甲学生设计的实验方案中D装置中的试剂为______________________(填化学式)。
②乙学生设计的方案是:将反应后的溶液冷却后全部移入到烧杯中稀释,并按正确操作配制100 mL溶液,再取20 mL于锥形瓶中,用________作指示剂,用标准氢氧化钠溶液进行滴定[已知:Cu(OH)2开始沉淀的pH约为5],选择该指示剂的理由为__________________________________________________;再求出余酸的物质的量,若耗去a mol/L氢氧化钠溶液b mL,则原余酸的物质的量为________mol(用含a、b的表达式来表示)。
5、选择题 有关SO2说法错误的是(?)
A.单质硫在空气中燃烧可生成SO2
B.SO2能使品红溶液褪色是因为它具漂白性,加热可恢复原本红色
C.SO2和Cl2都具有漂白作用,所以将两种气体等物质的量同时作用于潮湿有色物,可增强漂白作用
D.SO2能使加酚酞的NaOH溶液褪色是因为它能与NaOH反应