时间:2020-07-08 00:59:42
1、选择题 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。
已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lgc(SO42-)。下列说法正确的是
A.该温度下,Ksp (BaSO4 )=1.0×10-24
B.a点的Ksp (BaSO4 )小于b点的Ksp (BaSO4 )
C.d点表示的是该温度下BaSO4的不饱和溶液
D.加入BaCl2可以使溶液由 c点变到a点
参考答案:D
本题解析:A、硫酸钡电离产生硫酸根离子和钡离子,a点时p(Ba2+)=-lgc(Ba2+)=4,则c(Ba2+)=10-4mol/L,p(SO42-)=-lgc(SO42-)=6,则c(SO42-)=10-6mol/L,所以该温度下,Ksp (BaSO4 )= c(Ba2+) c(SO42-)=1.0×10-10,错误;B、温度相同,硫酸钡的溶度积相同,错误;C、因为p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lgc(SO42-)是减函数,数值越小,则对应的两种浓度越大,所以d点时c(Ba2+) c(SO42-)>1.0×10-10,则溶液为过饱和溶液,错误;D、c点时加入氯化钡溶液,则溶液中的钡离子浓度增大,p(Ba2+)减小,则溶解平衡逆向移动,硫酸根离子浓度减小,p(SO42-)增大,可由c点变到a点,正确,答案选D。
考点:考查对沉淀溶解平衡图像的分析判断
本题难度:一般
2、选择题 常温下,以下三种物质度积常数为:Ksp[Mg(OH)2]=1.2×10-11、Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=8.3×10-9。下列说法正确的是
A.温度升高,Ksp(AgCl)不变
B.向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)变大
C.常温下,将0.001 mol?L-1 AgNO3溶液滴入0.001 mol·L-1 KCl和 0.001 mol·L-1 K2CrO4溶液先产生Ag2CrO4沉淀
D.在Mg 2+为0.12 mol?L-1的溶液中要产生Mg(OH)2沉淀,应控制溶液的pH>9
参考答案:D
本题解析:溶度积常数只与温度有关系,升高温度,溶度积常数增大,A、B不正确;选项C中根据溶度积常数可知,生成氯化银和铬酸银时需要银离子的浓度分别是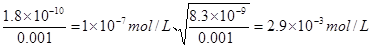 ,所以首先生成氯化银沉淀,C不正确;在Mg 2+为0.12 mol?L-1的溶液中要产生Mg(OH)2沉淀,则需要OH-的浓度是
,所以首先生成氯化银沉淀,C不正确;在Mg 2+为0.12 mol?L-1的溶液中要产生Mg(OH)2沉淀,则需要OH-的浓度是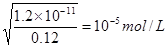 ,则此时pH=9,选项D正确,答案选D。
,则此时pH=9,选项D正确,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是明确溶度积常数的含义以及表达式,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力和发散思维能力,也有助于培养学生分析、归纳、总结问题的能力,提高学生的应试能力。
本题难度:一般
3、选择题 已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.Cl-、Br-、CrO42-
B.CrO42-、Br、Cl-
C.Br-、Cl-、CrO42-
D.Br、CrO42-、Cl-
参考答案:C
本题解析:设Cl-、Br-、CrO42-刚开始沉淀时,银离子的浓度分别为x mol、y mol、z mol,则根据Ksp可得:
0.01x=1.56×10-10
0.01y=7.7×10-13
0.01z2=9×10-11
可分别解出x≈1.56×10-8? y≈7.7×10-13? z≈3××10-4.5
可知y<x<z,开始沉淀时所需要的银离子浓度越小,则越先沉淀,因此答案为C
本题难度:一般
4、计算题 氢氧化镁难溶于水,但它所溶解的那一部分在溶液中完全电离。t ℃时,某饱和氢氧化镁溶液的pH=11,若不考虑KW值的变化,则该温度下的氢氧化镁的溶解度是。
参考答案:0.002 9 g
本题解析:pH=11,则c(OH-)="0.001" mol·L-1,所以,c〔Mg(OH)2〕="0.000" 5 mol·L-1,即1 000 g水中可溶解0.000 5 mol的Mg(OH)2,即S="0.000" 5×58 g="0.002" 9 g。
本题难度:简单
5、选择题 已知H2CrO4是弱酸,在一饱和Ag2CrO4水溶液(含有Ag2CrO4固体)中,添加下列试剂能使c(CrO42-)减少的是
[? ]
A. NH3
B. 硝酸
C. 水
D. AgNO3
参考答案:BD
本题解析:
本题难度:一般