时间:2020-07-08 00:59:42
1、填空题 钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。已知:
SrSO4(s)  Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7
Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7
SrCO3(s)  Sr2+(aq)+CO32-(aq) Ksp=2.5×10-9
Sr2+(aq)+CO32-(aq) Ksp=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为________________________,该反应的平衡常数表达式为____________;该反应能发生的原因是___________________________________________。(用沉淀溶解平衡的有关理论解释)
(2)对于上述反应,实验证明增大CO32-的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将________;
②增大CO32-的浓度,平衡常数K将________。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。
实验所用的试剂为________;实验现象及其相应结论为____________________________。
参考答案:(1)SrSO4(s)+CO32-(aq)  SrCO3(s)+SO42-(aq)? K=
SrCO3(s)+SO42-(aq)? K=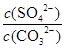 ? Ksp(SrCO3)<Ksp(SrSO4),加入CO32-后,平衡SrSO4(s)
? Ksp(SrCO3)<Ksp(SrSO4),加入CO32-后,平衡SrSO4(s)  Sr2+(aq)+SO42-(aq)正向移动,生成SrCO3
Sr2+(aq)+SO42-(aq)正向移动,生成SrCO3
(2)①减小 ②不变
(3)盐酸 若沉淀完全溶解,则证明SrSO4完全转化成SrCO3,否则,未完全转化
本题解析:(1)SrSO4转化成SrCO3的离子反应为:SrSO4(s)+CO32-(aq)?SrCO3(s)+SO42-(aq),根据沉淀转化的原理,该反应能够发生,是因为Ksp(SrCO3)<Ksp(SrSO4)。(2)①降低温度有利于提高SrSO4的转化率,说明降温平衡向正反应方向移动,因此升高温度,平衡向逆反应方向移动,故平衡常数K减小。②平衡常数只与温度有关,增大CO32-的浓度,平衡常数不变。(3)根据提供的信息,可以推断SrSO4难溶于盐酸,而SrCO3可溶于盐酸,因此向溶液中加入盐酸,若沉淀全部溶解,则SrSO4完全转化成SrCO3,若沉淀没有全部溶解,则SrSO4没有完全转化成SrCO3,需要注意的是,不能选择稀硫酸,因为SrCO3与稀硫酸反应生成SrSO4。
本题难度:一般
2、选择题 粗制的CuSO4·5H2O晶体中含有Fe2+。提纯时,为了除去Fe2+,常加入少量H2O2,然后再加入少量碱至溶液pH=4,即可以除去铁离子而不损失硫酸铜。下列说法不正确的是
A.溶解CuSO4·5H2O晶体时要加入少量稀H2SO4
B.加入H2O2,除Fe2+的离子方程式:2Fe2+ + H2O2 + 4OH- ="=" 2 Fe(OH)3
C.由于CuSO4的催化作用,会使部分H2O2分解而损失
D.调溶液pH=4的依据是当pH=4时Fe(OH)3沉淀完全,而Cu(OH)2还未开始沉淀
参考答案:B
本题解析:A、硫酸铜溶解后生成的铜离子会发生水解生成氢氧化铜和硫酸,所以溶解时加入少量的稀硫酸可抑制铜离子的水解,正确;B、因为氧化亚铁离子时,溶液为酸性,在酸性条件下,不可能生成氢氧化铁沉淀,错误;C、铜离子对过氧化氢的分解具有催化作用,所以使部分过氧化氢流失,正确;D、因为该操作的目的是除去铁离子而硫酸铜不损失,所以调节溶液的pH=4时,应是氢氧化铁完全沉淀而氢氧化铜还未沉淀,正确,答案选B。
考点:考查对物质制备的分析,物质性质的应用
本题难度:一般
3、选择题 下列说法不正确的是? ( )
A.Ksp只与难溶电解质的性质和温度有关
B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀
C.其他条件不变,离子浓度改变时,Ksp不变
D.两种难溶电解质作比较时,Ksp小的,溶解度一定小
参考答案:D
本题解析:相同温度下不同的难溶电解质,溶度积常数不同,这是由物质本身的性质决定的,对同一难溶电解质来说,温度不同,Ksp不同,Ksp不受其他因素的影响。同种类型的难溶电解质Ksp越小,溶解度越小。
本题难度:一般
4、选择题 以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2.根据上述实验事实,可推知MnS具有的相关性质是( )
A.具有吸附性
B.溶解度与CuS、PbS、CdS等相同
C.溶解度大于CuS、PbS、CdS
D.溶解度小于CuS、PbS、CdS
参考答案:沉淀向溶解度更小的方向转化,因此MnS的溶解度大于CuS、PbS、CdS的溶解度.
故选C.
本题解析:
本题难度:简单
5、填空题 [化学—选修:化学与技术]三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:
(1)氯化水解法生产三氯氧磷的化学方程式为 。
(2)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是 (选填字母),滴定终点的现象为 。
a.NH4Fe(SO4)2 b.FeCl2 c.甲基橙 d.淀粉②实验过程中加入硝基苯的目的是 ,如无此操作所测Cl元素含量将会 (填“偏大”、“偏小”或“不变”)
(3)氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水。在废水中先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是 。
②下图是不同条件对磷的沉淀回收率的影响图像。
处理该厂废水最合适的工艺条件为 (选填字母)。
a.调节pH=9 b.调节pH=10 c.反应时间30 min d.反应时间120 min
③若处理后的废水中c(PO43-)=4×10-7 mol·L-1,溶液中c(Ca2+)= mol·L-1。(已知Ksp[Ca3(PO4)2]=2×10-29)
参考答案:(1)PCl3+H2O+Cl2=POCl3+2HCl (2)①a;溶液变为红色
②防止滴加NH4SCN时,将AgCl沉淀转化为AgSCN沉淀;偏小(3)①将沸水中的H3PO3氧化为PO43-,使其加入生石灰后转化为磷酸的钙盐 ②bc ③5×10-6
本题解析:(1)氯化水解法生产三氯氧磷的同时还有氯化氢生成,因此反应的化学方程式为PCl3+H2O+Cl2=POCl3+2HCl;
(2)①SCN-能与铁离子结合使溶液显红色,所以指示剂选择NH4Fe(SO4)2,滴定终点的现象为溶液变为红色;答案选a;溶液变为红色;
②根据溶度积常数可知,氯化银的溶度积常数大于AgSCN的溶度积常数,,氯化银沉淀容易转化为AgSCN沉淀。因此硝基苯的作用是防止滴加NH4SCN时,将AgCl沉淀转化为AgSCN沉淀;如无此操作所测Cl元素含量将会导致AgCl沉淀转化为AgSCN沉淀,从而使得氯离子的含量偏低;
(3)①氯化水解法生产三氯氧磷的同时会产生磷酸和亚磷酸,要转化为磷酸的钙盐沉淀并回收,则需要将亚磷酸氧化转化为磷酸。而漂白粉具有氧化性,能将沸水中的H3PO3氧化为PO43-,使其加入生石灰后转化为磷酸的钙盐;
②根据图1可知pH=10时,回收率高,而残留溶解性磷浓度低,所以b正确;根据图2可知,反应进行30min或120min时,回收率以及而残留溶解性磷浓度相差不大,因此c正确,答案选bc;
③已知Ksp[Ca3(PO4)2]=2×10-29,当溶液中c(PO43-)=4×10-7 mol·L-1时,此时溶液中c(Ca2+)= =5×10-6mol·L-1。
=5×10-6mol·L-1。
考点:考查物质制备、滴定实验以及溶度积常数的应用与计算等
本题难度:困难