时间:2020-07-08 00:59:21
1、选择题 下列说法正确的是( )
A.在标准状况下,11.2L某气体的质量为22g,则该气体的相对分子质量是44g/mol
B.16gO2和16gO3含的氧原子个数一样多
C.在标准状况下,水、氧气和氮气分子间的平均距离都相等
D.1mol氯化钙溶于水配成1L溶液,所得溶液中Cl-的物质的量浓度为1mol/L
参考答案:A.n=11.2L22.4L/mol=0.5mol,质量为22 g,则M=22g0.5mol=44g/mol,相对分子质量为44,故A错误;
B.都由O元素组成,质量相等时,原子个数相等,故B正确;
C.物质的聚集状态不同,分子间距离不同,标准状况下,氧气和氮气相等,水的最小,故C错误;
D.1 mol氯化钙含有2molCl-,溶于水配成1 L溶液,所得溶液中Cl-的物质的量浓度为2 mol/L,故D错误.
故选B.
本题解析:
本题难度:简单
2、选择题 下列物质中含氧原子最多的是 (相对原子质量 H—1? O—16? S—32)
A.0.2mol H2O
B.3.01×1023个SO2分子
C.49g H2SO4
D.标准状态下11.2L的O3
参考答案:C
本题解析:根据所给的量算出各选项中含氧原子的物质的量,A:0.2mol; B:1mol;C:2mol;D:1.5mol。经过比较可以选出C选项。
点评:本题考查物质的量表达式,难度不大,属于学业水平考试常考点。
本题难度:一般
3、实验题 (14分)I.实验室用Na2CO3·10H2O晶体配制50 g质量分数为21.2%的Na2CO3溶液。回答下列问题:
(1)应用托盘天平称取Na2CO3·10H2O晶体??g。
(2)用托盘天平和小烧杯称出碳酸钠晶体的质量,天平平衡后的状态如下图。由图中可以看出,该同学在操作时犯了一个错误是?。实际称量的碳酸钠晶体质量为?g。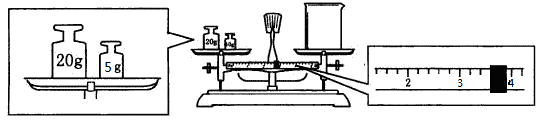
II. 实验室要配制2.5 mol/L 的稀硫酸溶液90 mL,回答下列问题:
(1)用量筒量取质量分数为98%,密度为1.84 g/cm3的浓硫酸?mL。
(2)配制时,必须使用的仪器除量筒、烧杯、玻璃棒外,还缺少的仪器是?。
(3)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是?。
A.量取浓硫酸时,仰视读数
B.洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
C.稀释硫酸时,有溶液溅到桌面上
D.没有洗涤稀释硫酸的烧杯和玻璃棒
E.定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
F.容量瓶不干燥
(4)从容量瓶中取该溶液40 mL,与5 mol/L的NaOH溶液?mL恰好完全反应,反应后溶液中的c(Na+)=?(忽略溶液混合过程中的体积变化)
参考答案:I.(1)28.6(2分)
(2)砝码和物品的位置放反了(1分) 21.4(1分)
II.(1)13.6(2分)
(2)100 mL容量瓶、胶头滴管(2分)
(3)A? B(2分)
(4)40 mL(2分) 2.5 mol/L(2分)
本题解析:考查一定物质的量浓度溶液的配制及误差分析等。
I.(1)50 g质量分数为21.2%的Na2CO3溶液中溶质的质量是50g×21.2%=10.6g,则碳酸钠的物质的量是0.1mol,所以需要Na2CO3·10H2O晶体的质量是0.1mol×286g/mol=28.6g。
(2)根据图示控制,错误是砝码和物品的位置放反了,因此实际固体的质量应该是25-3.6g=21.4g。
II.(1)由于容量瓶的规格没有90ml的,所以应该配制100ml,则需要浓硫酸的体积是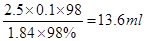 。
。
(2)配制100ml溶液,则一定需要100 mL容量瓶,以及定容时的胶头滴管。
(3)根据c=n/V可知,量取浓硫酸时,仰视读数,则浓硫酸的体积偏大,结果偏高;洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中,则溶质增加,浓度偏高;稀释硫酸时,有溶液溅到桌面上,则溶质减少,浓度偏小;没有洗涤稀释硫酸的烧杯和玻璃棒,则溶质减少,浓度偏小;定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,则容量瓶中溶液体积增加,浓度偏小;容量瓶不干燥,不会影响实验结果,答案选AB。
(4)40ml溶液中溶质硫酸的物质的量是0.04L×2.5mol/L=0.1mol,所以能消耗0.2mol氢氧化钠,因此需要氢氧化钠溶液的体积是40ml。反应后钠离子的浓度是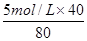 =2.5 mol/L。
=2.5 mol/L。
本题难度:一般
4、选择题 由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同.则该混合气体中CO2、H2和CO的体积比可能为(?)
A.29∶8∶13
B.22∶1∶14
C.13∶8∶29
D.29∶16∶57
参考答案:C
本题解析:由于CO和氮气的相对分子质量相等,所以二者的密度也是相等的。因此只要满足CO2和氢气的平均相对分子质量是28即可,所以二者的体积之比是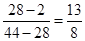 ,选项C正确,所以答案选C。
,选项C正确,所以答案选C。
本题难度:一般
5、选择题 已知某饱和溶液的①溶液的质量?②溶剂质量?③溶液体积?④溶质的摩尔质量?⑤溶质的溶解度?⑥溶液的密度。利用以上部分已知条件不可计算该溶液物质的量浓度的是(? )
A.①②④⑥
B.④⑤⑥
C.②③④⑤
D.①③④⑥
参考答案:D
本题解析:选项A中由①和②求出溶质的质量,其结果与④结合求出溶质的物质的量,由①和⑥推出溶液的体积,根据公式c=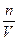 求出物质的量浓度。B项中根据⑤推出溶液的质量分数,④和⑥已知,根据公式:物质的量浓度=
求出物质的量浓度。B项中根据⑤推出溶液的质量分数,④和⑥已知,根据公式:物质的量浓度= 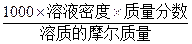 即可推出。C项中根据⑤推得溶质的质量,其结果与④推出溶质的物质的量,再根据已知条件③,推出溶质的物质的量浓度。D项中没有溶质质量,无法求溶质的物质的量,不能计算溶液的物质的量浓度。
即可推出。C项中根据⑤推得溶质的质量,其结果与④推出溶质的物质的量,再根据已知条件③,推出溶质的物质的量浓度。D项中没有溶质质量,无法求溶质的物质的量,不能计算溶液的物质的量浓度。
本题难度:简单