时间:2020-07-08 00:59:21
1、填空题 金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
⑴工业上处理酸性含Cr2O72-废水的方法如下:
①向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式:?。
②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为?;25℃,若调节溶液的pH=8,则溶液中残余Cr3+的物质的量浓度为?mol/L。(已知25℃时,Ksp[Cr(OH)3]=6.3×10-31)
⑵铬元素总浓度的测定:准确移取25.00mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015mol/L的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mL。
计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。
已知测定过程中发生的反应如下:
①2Cr3++3S2O82-+7H2O =Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O
③I2+2S2O32-=2I-+S4O62-
参考答案:
⑴①Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
②将pH试纸置于洁净的表面皿上,用玻璃棒蘸取溶液, 点在pH试纸上,并与标准比色卡对照
6.3×10-13
⑵由方程式可知:Cr~3Na2S2O3
n(Na2S2O3)=20.00mL×0.015mol/L=3×10-4mol
n(Cr)=1×10-4mol
m(Cr)=1×10-4mol×52g·mol-1=5.2×10-3 g=5.2mg
废水中铬元素总浓度=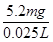 =208 mg·L-1
=208 mg·L-1
本题解析:(1)①发生氧化还原反应,亚铁离子被氧化为铁离子,Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;②实验室粗略测定溶液pH的方法是使用pH试纸,将pH试纸置于洁净的表面皿上,用玻璃棒蘸取溶液,点在pH试纸上,并与标准比色卡对照;则溶液中残余Cr3+的物质的量浓度为
Ksp[Cr(OH)3]÷(OH-)3=6.3×10-31÷10-18=6.3×10-13;
(2)由方程式确定关系式:Cr~3Na2S2O3
n(Na2S2O3)=20.00mL×0.015mol/L=3×10-4mol
n(Cr)=1×10-4mol
m(Cr)=1×10-4mol×52g·mol-1=5.2×10-3 g=5.2mg
废水中铬元素总浓度=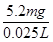 =208 mg·L-1
=208 mg·L-1
本题难度:一般
2、填空题 (4分)在标准状况下,①4g氢气 ②33.6 L甲烷 ③6.02×1023个水分子,含分子数最多的是(填序号,下同) ,含原子数最多的是 ,质量最大的是 ,体积最小的是 。
参考答案:(4分) ① ; ② ; ② ; ③
本题解析:略
本题难度:一般
3、选择题 只给出下表中甲和乙对应的量,不能用来求物质的量的是( )
| | ① | ② | ③ | ④ |
| 甲 | 物质的微粒数 | 标准状况下气体摩尔体积 | 固体体积 | 非标准状况下物质的质量 |
| 乙 | 阿伏加德罗常数 | 标准状况下气体体积 | 固体密度 | 物质的摩尔质量 |
参考答案:C
本题解析::①已知物质的微粒数和阿伏加德罗常数,根据N=nNA可知,n=N/NA可以计算出物质的量,所以①正确;②已知标准状况下的气体摩尔体积和标准状况下的气体的体积,根据V=nVm可知,n=V/Vm可以计算出物质的量,②正确;③已知固体的体积和固体的密度,根据m=ρV可以计算固体的质量,不能求出物质的量,③错误;④已知物质的质量和物质的摩尔质量,
根据n=m/M可以计算出物质的量,④正确,所以①②④可以计算出物质的量,③不能求出物质的量。选择C
考点:阿伏加德罗常数;气体摩尔体积
点评:考查常用化学计量的计算公式,难度较小,注意基础知识的学习掌握。在做这样的题目时,需要一个一个来推算,注意细节。
本题难度:一般
4、计算题 在标准状况下,将537.6L氯化氢气体溶于水配成2L溶液,试计算:
⑴该盐酸的物质的量浓度是多少?
⑵8.7gMnO2与100mL该盐酸反应,生成的气体在标准状况下是多少升?
⑶向反应后的溶液中加入足量的AgNO3溶液,可生成沉淀的物质的量是多少?
参考答案:⑴12mol/L? ⑵? 2.24L?⑶1mol
本题解析:(1)盐酸的浓度为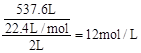 。
。
(2)? MnO2 + 4HCl(浓)  ?MnCl2 + Cl2↑+ 2H2O
?MnCl2 + Cl2↑+ 2H2O
1mol? 4mol? 22.4L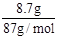 ?12mol/L×0.1L? VL
?12mol/L×0.1L? VL
根据数据可知浓盐酸过量,所以V=2.24L。
(3)溶液中剩下的Cl-有12mol/L×0.1L-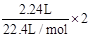 =1mol,则生成AgCl为1mol。
=1mol,则生成AgCl为1mol。
点评:本题非常基础,主要根据方程式进行计算。
本题难度:一般
5、选择题 NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,将m1克锌加入到m2克20%的盐酸中放出nLH2,则转移电子数为nNA/11.2
B.0.1mol/L的100mlH2SO4溶液中,含有的离子数为0.03 NA
C.9gD2O中含有的电子数为5NA
D.120g由NaHSO4和KHSO3组成的混合物中共含有3NA的阴阳离子
参考答案:D
本题解析:A正确,标准状况下,nLH2物质的量为n/22.4 mol,生成1mol氢气转移2mol电子,所以此反应转移电子数为nNA/11.2
B 错误,溶液中水也部分电离出氢离子和氢氧根离子
C 错误,9gD2O不是0.5mol
D 错误,120g由NaHSO4和KHSO3组成的混合物中共含有2NA的阴阳离子
故选A
本题难度:简单