时间:2020-07-08 00:58:39
1、选择题 已知氢气和碳燃烧的热化学方程式为:
①2H2(g)+O2(g)==2H2O(l);△H1=-akJ·mol-1
②H2(g)+1/2O2(g)==H2O(g);△H2=-bkJ·mol-1
③C(s)+1/2O2(g)==CO(g);△H3=-ckJ·mol-1
④C(s)+O2(g)==CO2(g);△H4=-dkJ·mol-1
且abcd均大于零,下列说法正确的是
[? ]
A.氢气的燃烧热为bkJ·mol-1
B.碳的燃烧热为ckJ·mol-1
C.一氧化碳的燃烧热为(c-d)kJ·mol-1
D.1/2a>b
参考答案:CD
本题解析:
本题难度:一般
2、选择题 下列物质的水溶液在适当加热时酸性增强的是
A.氯化铁
B.氯化钠
C.盐酸
D.碳酸钠
参考答案:
本题解析:A选项中铁离子在水溶液中能发生水解生成氢氧化铁和氢离子,水解反应为吸热反应,增大温度反应向吸热方向移动,氢离子浓度增大。故酸性会增强。
本题难度:简单
3、选择题 常温下,用0.1000 mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1CH3COOH溶液。当滴入NaOH溶液为20.00 mL时溶液显碱性,溶液中各离子浓度关系正确的是
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.c(Na+) + c(H+)=c(CH3COO-) + c(OH-)
D.c(Na+) + c(OH-)=c(CH3COO-) + c(H+)
参考答案:C
本题解析:由n=c?V可知,CH3COOH、NaOH的物质的量相等,恰好完全中和;生成的CH3COONa是强碱弱酸盐,能完全电离出钠离子和醋酸根离子,而水只能微弱地电离出氢离子和氢氧根离子;钠离子不能水解,而少部分醋酸根离子能水解;醋酸根离子与水电离出的氢离子反应生成醋酸,促进水的电离平衡右移,因此该溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),则c(Na+)+c(OH-)>c(CH3COO-)+c(H+),故ABD均错误;根据电荷守恒原理可知,溶液中c(Na+)+c(OH-)=c(CH3COO-)+c(H+),故C正确。
本题难度:一般
4、选择题 一定温度下,满足下列条件的溶液一定呈酸性的是
A.pH=6的某溶液
B.加酚酞后显无色的溶液
C.能与金属Al反应放出H2的溶液
D.c(H+)>c(OH—)的任意水溶液
参考答案:D
本题解析:A、当温度升高时,水的离子积增大,[H+]=[OH-]=10-6mol/L,此时溶液仍呈中性,故A错误;酚酞的变色范围是8-10,小于8时溶液显无色,可能为碱性、中性或酸性,故B错误;C、能与铝作用放出氢气的可能为强酸或强碱,故C错误;溶液的酸碱性决定于氢离子和氢氧根离子浓度的相对大小,当氢离子的浓度大于氢氧根离子的浓度时,溶液一定呈酸性,D正确;故选D。
本题难度:一般
5、填空题 (8分)甲醇(CH3OH)被称为21世纪的新型燃料,以煤为原料制备甲醇的流程如下: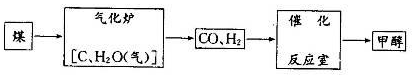
(1) 气化炉中主要反应的化学方程式为 。
(2)已知CO、H2、甲醇(l)的燃烧热分别为:—285.8 kJ/mol、—283 kJ/mol、—726.5 kJ/mol;
则CO和H2合成甲醇的热化学方程式为__ __
(3) -定条件下,在催化反应室中发生反应.CO(g)+2H2(g) =CH3OH(g)△H<0;
CO 的平衡转化率与温度、压强的关系如图所示。回答下列问题:
①工业上,上述反应温度不宜过高,原因是_ ___;
②若反应是1 mol CO与2 mol H2在2L容积中进行,则
T1、P1下,该反应的平衡常数为__ __;
维持温度、容积不变,催化反应室再增加l mol CO与2 mol
H2,达到新平衡时,CO的转化率____(填“增大”、“减小”或“不变”)。
参考答案:(1)C+ H2O (g) CO+H2
CO+H2
(2)CO(g)+2H2(g)=CH3OH(l) △H=-125.3kJ/mol
(3) ①该反应是放热反应,温度过高,甲醇的产率低;
②4 增大
本题解析: (1)气化炉中发生的反应是生成水煤气的反应,化学方程式为C+ H2O (g) CO+H2
CO+H2
(2)CO和H2合成甲醇的化学方程式为CO(g)+2H2(g)=CH3OH(l),该反应的反应热△H与CO、H2、甲醇(l)的燃烧热的关系是△H="—285.8" kJ/mol+2×(—283 kJ/mol)-(—726.5 kJ/mol)=-125.3kJ/mol,所以CO和H2合成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l) △H=-125.3kJ/mol;
(3)①该反应放热,温度过高,不利于正反应的进行,甲醇的产率降低;
②T1、P1下,CO的转化率是50%,所以平衡时甲醇的浓度为1mol/2L×50%=0.25mol/L,CO的平衡浓度也是0.25mol/L,氢气的平衡浓度是CO的2倍0.5mol/L,所以该条件下的平衡常数K=0.25mol/L/0.25mol/L×0.52mol/L=4(L/mol)2;维持温度、容积不变,催化反应室再增加l mol CO与2 molH2,CO与H2的比例与原平衡相同,等效为增大压强,平衡向体积减小的方向移动,即向正反应移动,CO的转化率增大。
考点:考查化学反应与能量的关系,化学平衡理论的应用
本题难度:困难