时间:2020-07-08 00:58:39
1、选择题 已知Ba(AlO2)2可溶于水。下图表示的是向含A12(SO4)3 0.01mol的溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系(其中a、c分别是0b段和bd段的中点)。下列有关叙述正确的是
A.a时沉淀的质量为3.495 g
B.b时沉淀的物质的量为0.05 mol
C.c时溶液中Ba2+离子的物质的量为0.005 mol
D.e时溶液中AlO2—的物质的量为0.01 mol
参考答案:BC
本题解析:硫酸铝和氢氧化钡反应的方程式是Al2(SO4)3+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓,如果继续加入氢氧化钡,则氢氧化铝开始溶解,反应的化学方程式是2Al(OH)3+Ba(OH)2=Ba(AlO2)2+4H2O。由于a、c分别是0b段和bd段的中点,所以a点生成0.01mol氢氧化铝和0.015mol硫酸钡,质量之和是3.495g+0.78g=4.275g,A不正确;b时沉淀是0.02mol氢氧化铝和0.03mol硫酸钡,其物质的量之和为0.05 mol,B正确;c点有0.01mol氢氧化铝溶解,生成0.005mol Ba(AlO2)2,此时溶液中Ba2+离子的物质的量为0.005 mol,C正确;e点溶液中的沉淀只有硫酸钡,氢氧化铝完全溶解,则溶液中AlO2—的物质的量为0.02mol,D不正确,答案选BC。
点评:该题是高考中的常见题型,属于综合性试题的考查,侧重对学生解题能力的培养。试题综合性强,贴近高考,旨在培养学生分析、归纳、总结问题的能力。有利于调动学生的学习兴趣和学习积极性,也有助于培养学生的逻辑推理能力和抽象思维能力。该题的关键是明确反应原理,然后结合题意和图像灵活运用即可。
本题难度:简单
2、选择题 pH=1的两种酸溶液A、B各1mL,分别加水稀释到 1000mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是
A.A、B两种酸溶液的物质的量浓度一定相等
B.若a=4,则A是强酸,B是弱酸
C.若1<a<4,则A、B都是弱酸
D.稀释后,A酸溶液的酸性比B酸溶液弱
参考答案:A
本题解析:由图可得B一定是弱酸,A可能是弱酸,也可能是强酸,取决与a的值;
A错,A、B两种酸溶液的物质的量浓度一定不相等;B正确,若a=4,则A是强酸,B是弱酸;C正确,若1<a<4,则A、B都是弱酸;D正确,由图可知,B的PH比A小,即酸性更强。
本题难度:一般
3、填空题 下列四种溶液中,①pH=0的盐酸②0.1 mol·L-1的盐酸③0.01 mol·L-1的NaOH溶液④pH=11的NaOH溶液。由水电离生成的氢离子浓度之比是__________________。
参考答案:1000∶100∶10∶1?(2分)
本题解析:略
本题难度:简单
4、填空题 pH = 2与pH = 5的两强酸溶液各10 mL,混合后溶液的pH为?。
参考答案:3-lg5
本题解析:考查溶液pH的计算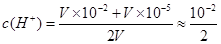 ,pH=lg
,pH=lg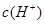 =3-lg5
=3-lg5
本题难度:简单
5、选择题 在80 ℃时,水的离子积KW=3.8×10-13,该温度时纯水的pH(?)
A.等于7
B.小于7
C.大于7
D.无法确定
参考答案:B
本题解析:纯水呈中性,c(H+)=c(OH-),即使升温至80 ℃时,仍为c(H+)=c(OH-),所以有KW=c(H+)·c(OH-)=[c(H+)]2=3.8×10-13,c(H+)=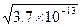 ?mol·L-1=6.16×10 -6 mol·L-1,所以选B。
?mol·L-1=6.16×10 -6 mol·L-1,所以选B。
本题难度:简单