时间:2020-07-08 00:57:15
1、选择题 [化学—物质结构与性质](13分)
Ⅰ.现今运动场馆大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED晶片,材质基本以GaAs(砷化镓)、InGaN(氮化铟镓)为主。砷化镓作为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。
已知砷化镓的晶胞结构如图所示。请回答下列问题: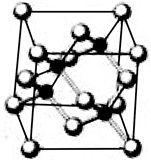
(1)下列说法正确的是?(填字母序号)。?
a.砷化镓晶胞结构与NaCl相同? b.第一电离能:As>Ga
c.电负性:As>Ga? d.砷化镓晶体中含有配位键?
e.GaP与GaAs互为等电子体
(2)AsH3空间构型为__ __;砷化镓可由(CH3)3Ga 和AsH3在700℃时制得,(CH3)3Ga中镓原子的杂化方式为?。
Ⅱ. 金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(3)Cu的价电子排布式为__________;请解释金属铜能导电的原因?。
(4)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中
含有的化学键除普通共价键外,还有?和?。已知NF3与NH3的空间构型都是三角锥形,单NF3不易与Cu2+形成配离子,其原因是?。
参考答案:(1)b c d e(2分)?(2)三角锥型(2分)? sp2?(2分)
(3)3d104s1(2分)?金属铜存在自由电子,通电后发生电子的定向移动产生电流(1分)
(4)配位键、离子键(2分)? F比H电负性大,吸引电子能力强,电子对强烈偏向于F,故N原子的孤电子对不易与Cu2+形成配位键?(2分)
本题解析::(1)a.GaAs晶体中As分布于晶胞体心,Ga分布于顶点和面心,而NaCl中阴阳离子分别位于晶胞的顶点、面心以及棱和体心,二者结构不同,故a错误;b.同周期元素从左到右第一电离呈增大趋势,但第VA族大于第IIIA族,第IIA族大于第IIIA族,所以则第一电离能:As>Ga,故b正确;c.同周期元素从左到右电负性逐渐增大,则电负性:As>Ga,故c正确;d.砷价电子数是5个而镓是3个,要满足8电子稳定结构,则 砷化镓晶体中含有配位键,故d正确;e.GaP的价层电子为3+5=8,SiC的价层电子为4+4=8,GaAs价层电子数为3+5=8,则为等电子体,故e正确;故答案为:bcde;(2)AsH3中含有3个δ键和1个孤电子对,为三角锥形,(CH3)3Ga中Ga形成3个δ键,没有孤电子对,为sp2杂化;
(3)Cu的原子序数是29,根据核外电子排布规律可知铜的价电子排布式为3d104s1。由于金属铜存在自由电子,通电后发生电子的定向移动产生电流,因此金属铜能导电;
(4)根据物质的结构可知,铜离子与硫酸根离子之间还存在离子键。铜离子与氨气分子间还存在配位键。由于F比H电负性大,吸引电子能力强,电子对强烈偏向于F,故N原子的孤电子对不易与Cu2+形成配位键。
本题难度:一般
2、选择题 美国科学家宣称发现了普通盐水在无线电波照射下可燃烧,有望解决用水作人类能源的重大问题。无线电频率可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种频率下持续燃烧。上述中“结合力”实质是
[? ]
A.分子间作用力
B.氢键
C.非极性共价键
D.极性共价键
参考答案:D
本题解析:
本题难度:简单
3、填空题 (12分)已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是_______________;
(2)Q的具有相同化合价且可以相互转变的氧化物是_________;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 _________________;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)________________,其原因是____________________;
②电子总数相同的氢化物的化学式和立体结构分别是_________________________.;
(5)W和Q所形成的结 构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是?________
构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是?________
参考答案:(1)原子晶体。(2)NO2和N2O4(3)As2S5。(4)①NH3> AsH3 > PH3,因为前者中含有氢键,后两者构型相同,分子间作用力不同;②电子数相同的有SiH4、PH3和H2S结构分别为正四面体,三角锥和V形。(5)SiCl4 + 4NH3 = Si(NH2)4 + 4HCl,3Si(NH2)4 = 8NH3 + Si3N4
本题解析:略
本题难度:一般
4、简答题 (2008?上海,23)四种短周期元素的性质或结构信息如下表.请根据信息回答下列问题.
| 元素 | A | B | C | D 性质或 结构 信息 室温下单质呈粉末状固体,加热易熔化;单质在氧气中燃烧,发出明亮的蓝紫色火焰 单质常温、常压下是气体,能溶于水;原子的M层上有7个电子 单质质软、银白色固体、导电性强;单质在空气中燃烧发出黄色的火焰 原子最外电子层有4个电子;单质为空间网状晶体,具有很高的熔、沸点 |
参考答案:(1)B元素从“气体”可知是非金属元素,从M层上有7个“电子”知是Cl元素,位于元素周期表第三周期ⅦA族,
A元素的单质在氧气中燃烧,发出明亮的蓝紫色火焰,应是S元素,其电子式为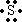
,
故答案为:第三周期ⅦA族;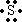
;
(2)C单质的焰色反应呈黄色,则C为Na,为活泼金属,与水剧烈反应生成NaOH和氢气,
反应的方程式为2Na+2H2O═2NaOH+H2↑,生成NaOH,溶液呈碱性,PH大于7,
故答案为:2Na+2H2O═2NaOH+H2↑;大于;
(3)D元素最外层电子数为4,结合空间网状结构和“很高的熔、沸点”应该是C元素或Si元素,
最高价氧化物为SiO2或CO2,SiO2是原子晶体,硬度大,CO2是分子晶体,硬度小,
故答案为:大;SiO2是原子晶体(或小;CO2是分子晶体);
(4)同周期元素从左到右元素的非金属性逐渐增强,比较元素非金属性的强弱可从它们之间的相互置换、氢化物的稳定性、最高价氧化物的水化物的酸性强弱等方面去判断,
故答案为:Cl;高氯酸的酸性大于硫酸的酸性或氯化氢稳定性比硫化氢强.
本题解析:
本题难度:一般
5、选择题 原子个数相同、核外电子数相同的分子(离子)的空间构型相同。以下微粒为三角锥形的是
A.NH4+
B.H3O+
C.H2S
D.CH4
参考答案:B
本题解析:A.铵根离子中价层电子对数=(5-1+4×1)/2=4,且不含孤电子对,所以其空间构型是正四面体型,故A不符合; B.水合氢离子中,价层电子对数=4,且含有一个孤电子对,所以其空间构型是三角锥型,故B符合; C.硫化氢分子中,价层电子对=3,且含有一个孤电子对,所以其空间构型是V型,故C不符合; D.甲烷分子中,价层电子对=4,且不含孤电子对,所以其空间构型是正四面体型,故D不符合;故选B.
本题难度:一般