时间:2020-07-08 00:57:15
1、选择题 下列有关叙述中,正确的是
[? ]
A.Na2O2固体中,阳离子与阴离子的个数比为1:1
B.CH3Cl的电子式为: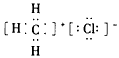
C.核素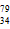 Se中的质子数为34,中子数为79
Se中的质子数为34,中子数为79
D.氧原子的结构示意图为: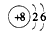
参考答案:D
本题解析:
本题难度:简单
2、选择题 图为周期表前4周期的一部分,下列关于a、b、c、d、e的叙述正确的是( )
A.b元素除0价外,只有一种化合价
B.五种元素中,c元素形成的单质性质最稳定
C.c、d元素最高价氧化物的水化物酸性:c>d
D.e元素在自然界中主要存在于海水中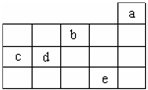
参考答案:图为周期表前4周期的一部分,由元素在周期表中的位置可知,a为He,b为O,c为Si,d为P,e为Br,
A.b为氧元素,有0、-1、-2价,故A错误;
B.氦气的化学性质最稳定,故B错误;
C.非金属性Si<P,故酸性:磷酸>硅酸,故C错误;
D.e为溴元素,主要以盐的形式存在与海水中,故D正确;
故选D.
本题解析:
本题难度:简单
3、选择题 下列叙述正确的是
[? ]
①两种原子构成的共价化合物分子中的化学键都是极性键
②两种不同非金属元素原子间形成的化学键都是极性键
③含有非极性键的化合物一定是共价化合物
④只要是离子化合物,其熔点就比共价化合物的熔点高
⑤难失?去电子的原子,易形成阴离子
⑥单质分子中不存在化学键,化合物的分子中才存在化学键
⑦离子化合物中一定含有离子键
A.只有②⑦?
B.只有①⑦
C.只有⑦?
D.只有①⑤⑦
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列分子中既不存在s-p σ键,也不存在p-p π键的是
[? ]
A.HCl
B.HF
C.SO2
D.SCl2
参考答案:D
本题解析:
本题难度:简单
5、选择题 Cs是ⅠA族元素,F是ⅦA族元素,估计Cs和F形成的化合物可能是
A.离子化合物
B.化学式为CsF2
C.共价化合物
D.室温为气体
参考答案:A
本题解析:Cs是ⅠA族元素容易失去一个电子形成阳离子,F是ⅦA族元素,容易得到一个电子形成阴离子,故Cs和F形成的应为离子化合物,化学式为CsF,它在室温时以固体形式存在,形成离子晶体。
本题难度:简单