时间:2020-07-08 00:56:53
1、选择题 A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是( )
A.X元素可能为Al
B.X元素不一定为非金属元素
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应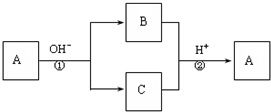
参考答案:D
本题解析:
本题难度:一般
2、推断题 下图中的反应①是重要的电化学工业反应,反应②可用于制备新型消毒净水剂Na2FeO4。常温下B、C为气态单质,G是当代社会使用量最大的金属,其余均为化合物。(反应时加入或生成的水,以及生成沉淀I时的其他产物均已略去)。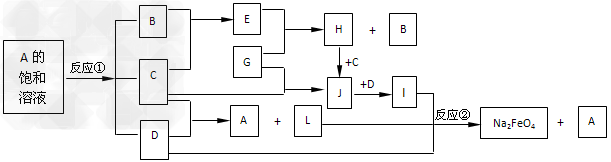
请回答下列问题:
(1)L的电子式为_______________。
(2)J溶液蒸干灼烧得到的物质是(填化学式)_______________。
(3)反应①的化学方程式是____________________________________。
(4)反应②的离子方程式是____________________________________。
(5)Na2FeO4能起到消毒净水的原理是______________________。(用文字叙述)
参考答案:(1) (2)Fe2O3
(2)Fe2O3
(3)2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(4)2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
(5)Na2FeO4中+6铁具有强氧化性,能起到杀菌消毒作用,其还原产物为+3价铁易水解,形成Fe(OH)3胶体,具有净化作用
本题解析:
本题难度:一般
3、选择题 根据下列框图,有关说法正确的是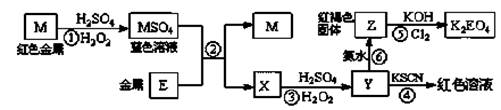
A.M、E都是第四周期中的过渡元素,E的金属活动性比M的金属活动性强,E3+的氧化性比M2+的氧化性弱
B.反应⑤的离子方程式可表示为:2E(OH)3 +3Cl2 +6H2O =3EO4 2―+ 6Cl― +12H+
C.反应①、②、③、⑤都属于氧化还原反应,且在反应①和③中硫酸仅表现了酸性
D.用K2EO4、Zn可制成一种高能电池,该电池中负极的电极反应式为:
EO42―+4H2O+3e-=E(OH)3+5OH―
参考答案:C
本题解析:流程分析可知,M为铜,在酸性溶液中被过氧化氢氧化为铜盐溶液CuSO4,依据Y加入KSCN溶液血红色说明是Fe3+离子,和氨水反应生成红褐色沉淀氢氧化铁;说明X为亚铁离子形成的硫酸亚铁溶液,推断E为Fe,则X为FeSO4,Y为Fe2(FeSO4)3,Z为Fe(OH)3,A、Fe2+的氧化性比Cu2+的氧化性弱,但Fe3+的氧化性比Cu2+强,如2Fe3++Cu═2Fe2++Cu2+,故A错误;B、Fe(OH)3可被氯气氧化生成高铁酸钾,反应在碱性条件下进行,不可能生成H+,应为2E(OH)3+3Cl2+12OH-=3EO42-+6Cl-+6H2O,故B错误;C、①②⑤都有单质参加反应,③有过氧化氢参加反应,则一定为氧化还原反应,①和③中硫酸都只表现了酸性,表现氧化性的为过氧化氢,故C正确;D、负极发生氧化反应,应是锌失电子被氧化,故D错误,答案选C。
本题难度:一般
4、填空题 A、B、C、D、E是Na的单质及其化合物,它们有如图所示的相互转化关系.
(1)写出以下物质的化学式:C______;F______
(2)完成以下离子方程式:
C→D:______
D→E:______
(3)等质量的A和B分别投入到等质量且足量的水中,反应后所得溶液溶质质量分数分别为
ω1、ω2,则ω1______ω2(填“>”或“<”或“═”).
(4)E中混有少量的F,用化学方程式表示除去F的两种方法:______、______
(5)用mg的D来制取纯净的E,写出最简单的实验方法______.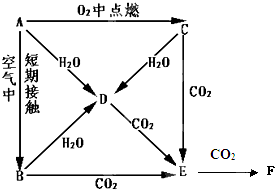
参考答案:A、B、C、D、E是Na的单质及其化合物,由转化关系可知,A为Na,C为Na2O2,B为Na2O,D为NaOH,E为Na2CO3,F为NaHCO3,
(1)由上述分析可知C为Na2O2,F为NaHCO3,故答案为:Na2O2;NaHCO3;
(2)C→D的离子反应为2Na2O2+2H2O=4Na++4OH-+O2↑,D→E的离子反应为2OH-+CO2=CO32-+H2O,故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;2OH-+CO2=CO32-+H2O;
(3)设质量均为46g,水的质量为m,
由2Na+2H2O=2NaOH+H2↑可知,n(NaOH)=2mol,溶液的质量为46+m-2=m+44,由Na2O+H2O=2NaOH可知,n(NaOH)=4631mol,溶液的质量为46+m,钠与水反应生成的溶质的质量较大,则ω1>ω2,故答案为:>;
(4)除去F的方法为NaHCO3+NaOH=Na2CO3+H2O、2NaHCO3△.Na2CO3+CO2↑+H2O,
故答案为:NaHCO3+NaOH=Na2CO3+H2O;
(5)D来制取纯净的E,最简单的实验方法为将mgNaOH固体加一定量的水溶解,制成溶液.再将溶液分为等体积的两份,一份通入足量CO2,充分反应后与另一份溶液混合.最后再将溶液蒸干,
故答案为:将mgNaOH固体加一定量的水溶解,制成溶液.再将溶液分为等体积的两份,一份通入足量CO2,充分反应后与另一份溶液混合.最后再将溶液蒸干.
本题解析:
本题难度:一般
5、推断题 现有A、B、C、D四种短周期元素, A分别与B、C、D结合生成甲、乙、丙三种化合物, 且甲、乙、丙3分子中含相同数目的质子数,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图: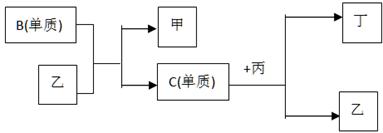
(1)写出B+乙→甲+C的化学反应方程式________________________________________。
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是_____。(填写序号)
① A? ② B? ③ C? ④ D
(3) 依据下列条件可以进一步确定上述第四种元素:
①甲与丙以及乙与丙均能够发生反应,②甲、丙、丁都是无色有刺激性气味的物质。
据此,请回答下列问题:
A.写出上述第四种元素在周期表中的位置?。
B.写出C+丙→乙+丁的化学反应方程式?。
参考答案:(1) 2F2+2H2O = 4HF+O2? (2) ④
(3) A. 第二周期第VA族
B.? 4NH3+5O2 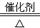 ?4NO+6H2O
?4NO+6H2O
本题解析:因为甲、乙、丙所含质子数相同,则可初步确定A是氢元素,考虑到B可置换C,可初步确定B是氟元素,C是氧元素,所以,D应该是碳元素或氮元素。如果确定B是氯元素,C是硫元素,则D为磷元素或硅元素,这与“C、D两元素形成丁”和“C单质与丙反应生成丁和乙”矛盾。 故A是H元素,B是F元素,C是O元素,D是N或C元素,甲是HF,乙是H2O,丙是NH3或CH4,丁是NO或CO2。
(1)由以上推断出的各个物质,方程式为2F2+2H2O = 4HF+O2。
(2)由以上推断出的各个物质,可知选④。
(3)依据题中所给的条件,判断出丙是NH3,丁是NO,故D是N元素。
A.N元素在周期表中的位置是第二周期第VA族。
B.氨的催化氧化方程式为4NH3+5O2 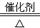 ?4NO+6H2O。
?4NO+6H2O。
点评:本题考查的是无机推断的相关知识,题目难度大,注意讨论法的应用,考查学生对基础知识的掌握程度。
本题难度:困难