时间:2020-07-08 00:55:52
1、选择题 如右图所示装配好仪器,接通直流电源,电解的是未精制的(含有少量CaCl2、MgCl2、Na2SO4等杂质)饱和食盐水,结果很快在某一电极附近出现浑浊现象。造成浑浊的难溶物主要是
A.碳酸镁
B.硫酸钡
C.氢氧化镁
D.碳酸钡
参考答案:C
本题解析:略
本题难度:一般
2、填空题 汽车尾气中NOx的消除及无害化处理引起社会广泛关注。
(1)某兴趣小组查阅文献获得如下信息:
N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
2H2(g)+O2(g)=2H2O(g)) △H=
参考答案:
本题解析:
本题难度:困难
3、填空题 某化学兴趣小组进行如下图所示的电化学实验,实验前查资料获知:铁氰化钾(K3[Fe(CN)6])遇Fe2+产生 蓝色沉淀。V形管以多孔Pt为电极;U形管A端滴入1~2滴K3[Fe(CN)6]溶液。 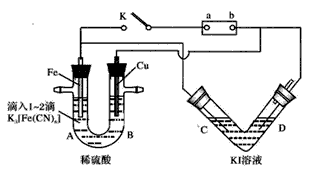
(1)开始时,接通K电键:U形管中无沉淀,却观察到B端____;根据以上实验可知电源正极为____(填“a”或“b”)。Fe电极上发生的电极反应为___,V形管中现象是___ 。
(2)断开K电键,U形管中现象:A端___;B端____,B端有关反应方程式为____。V形管中现象与(1)的____(填“相同”或“不同”)。
参考答案:(1)溶液变蓝色; b; 2H++2e-==H2↑ ;C端产生无色气体,D 端溶液变橙黄,C端液面低于D端液面
(2)产生蓝色沉淀; 溶液颜色变浅,产生无色气体(H2) ;Cu2++2e-==Cu、2H++2e-==H2↑? ;相同
本题解析:
本题难度:一般
4、填空题 化工中把电解饱和食盐水的工业生产叫氯碱工业,其生产流程如下: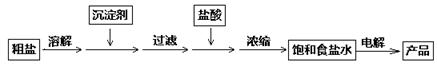
除去食盐水中的Ca2+、Mg2+、SO42—,应分别加入下列沉淀剂:①NaOH(aq)、
②Na2CO3(aq)、③BaCl2(aq),加入沉淀剂的顺序为 (填序号);加入盐酸的作用为 。
(2)下图为实验室电解饱和食盐水的实验装置。X、Y均为石墨电极,两极周围溶液均滴有几滴酚酞试液。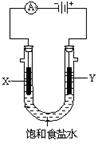
①电解一段时间后,X电极及附近溶液能观察到的现象是 ;
Y电极上的电极反应式为 ,检验该极产生的气体的方法是 。
②电解饱和食盐水的离子方程式为 ;若饱和食盐水体积为200mL,且忽略电解过程中的体积变化及气体溶解,当两极共收集到气体(共两种)44.8mL(标准状况)时,溶液的pH= 。
参考答案:
(1)①③②或③①②或③②① 除去过量的OH—和CO32—(或NaOH和Na2CO3)
(2)① X电极上有气泡产生,附近溶液逐渐变红色(各1分) 2Cl——2e—=Cl2↑
用湿润的淀粉KI试纸检验,若试纸变蓝,证明该极产生Cl2(合理答案均给分)
②2Cl-+2H2O H2↑+Cl2↑+2OH- 12
H2↑+Cl2↑+2OH- 12
本题解析:(1)加入的Na2CO3、NaOH、BaCl2分别除去Ca2+、Mg2+、SO42—,为了除去干净,试剂需加入过量,过量的Ba2+用后加入的Na2CO3,所以加入试剂的顺序只需要将Na2CO3放在BaCl2后面即可,后用盐酸除去多余的Na2CO3和NaOH;(2)电解饱和食盐水阴极反应为2H++2e—==H2↑,阳极反应式为2Cl——2e—=Cl2↑,总方程式为2Cl-+2H2O H2↑+Cl2↑+2;
H2↑+Cl2↑+2;
n(H2)=n(Cl2)=44.8÷22.4×10-3÷2=10-3mol,n(OH-)=2n(H2)=2×10-3mol
c(OH-)=2×10-3÷0.2=10-2,pH=12
考点:考查物质的分离实验和电解原理有关问题。
本题难度:一般
5、选择题 用石墨为电极材料电解时,下列说法正确的是
[? ]
A.电解NaOH溶液时,溶液浓度将减小,pH不变
B.电解H2SO4溶液时,溶液浓度将增大,pH不变
C.电解Na2SO4溶液时,溶液浓度将增大,pH不变
D.电解NaCl溶液时,溶液浓度将减小,pH不变
参考答案:C
本题解析:
本题难度:一般