时间:2020-07-08 00:55:52
1、实验题 在玻璃圆筒中盛有两种无色的互不相容的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
(1)阳极上的电极反应式为?。
(2)阴极上的电极反应式为?。
(3)原上层液体是?。
(4)原下层液体是?。
(5)搅拌后两层液体颜色发生变化的原因是?。
(6)要检验上层液体中含有的金属离子?,现象是?。
参考答案:(1)2I-—2e-=I2 。(2)2H++2e?- = H2↑。(3)NaI或KI。(4)四氯化碳。(5)I2易溶于四氯化碳,难溶于水。(6)焰色反应。若焰色为亮黄色为NaI,通过蓝色钴玻璃观察,若焰色为紫色为KI。
本题解析:略
本题难度:一般
2、填空题 (15)二氧化氯是黄绿色的气体,可用于水体消毒与废水处理。一种制备方法为:
__H2C2O4 +__NaClO3 +__H2SO4 →__Na2SO4+__CO2↑ +__ClO2↑ +__H2O
完成下列填空:
(1)配平上述反应方程式,该反应的还原产物是__________________________。
(2)该反应每产生0.2 mol ClO2,需要消耗草酸晶体(H2C2O4·2H2O)_________g。
(3)上述反应物中属于第三周期的元素的原子半径大小顺序是__________________________,
其中原子半径最大的元素最外层电子云形状为___________________________。
(4)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与__________相同。(写一种)
(5)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,请写出此反应的离子方程式:_______________________________________________。
(6)上述反应产物NaCl中含有 __________键,工业上用电解熔融的氯化钠制备金属钠,氯气在_________(写电极名称)产生。
参考答案:(1)1 2 1 1 2 2 2 (2分)ClO2(1分)(2)12.6(2分)(3)Na>S>Cl(2分);球形(1分)
(4)HClO(2分,合理即可) (5)2ClO2+2CN-→2CO2+N2+2Cl-(2分)
(6)离子(1分);阳极(2分)。
本题解析:(1)根据在氧化还原反应中电子守恒、原子守恒可得该方程式是:H2C2O4 +2NaClO3 +H2SO4 →Na2SO4+ 2CO2↑ + 2ClO2↑ + 2H2O。在该反应中氧化剂是NaClO3,所以变成的还原产物是ClO2。(2)根据方程式可知:每产生2mol的ClO2,会反应消耗1mol的草酸,所以若该反应产生0.2 mol ClO2,需要消耗草酸晶体0.1mol,其质量是0.1mol ×126g/mol="12.6g." (3)在上述反应物中属于第三周期的元素有Na、S、Cl,同一周期的元素,元素序数越大,原子半径就越小,所以原子半径大小顺序是Na>S>Cl;(4)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与HClO、Na2O2、H2O2相同。(5)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,该反应的离子方程式是:2ClO2+2CN-→2CO2+N2+2Cl-;(6)NaCl是离子化合物,其中的化学键是离子键;在工业上用电解熔融的氯化钠制备金属钠,根据同种电荷相互排斥,异种电荷相互吸引的原则,氯气是阴离子Cl-在阳极失去电子产生。
考点:考查氧化还原反应方程式的配平、方程式的书写、化合物的化学键类型的判断及有关计算的知识。
本题难度:一般
3、填空题 能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H________ 0。(填“>、<或=”下同)
CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H________ 0。(填“>、<或=”下同) 
(2)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO 和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的____________ 倍。
(3)利用甲醇燃料电池设计如下图所示的装置: ①则该装置中b为________ 极,写出装置中电解池内发生反应的离子方程式____________ , ②当锌片的质量变化为12.8 g时,a极上消耗的O2 在标准状况下的体积为____________ L。 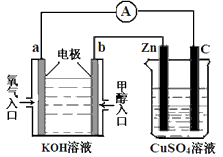
(4)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)== C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)== C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式______________ 。
参考答案:(1)<
(2)0.55
(3)①负; 2Cu2++2H2O 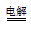 2Cu+O2↑+4H+;②2.24
2Cu+O2↑+4H+;②2.24
(4)C2H4(g)+H2O(l)=== C2H5OH(l) △H=-44.2 kJ/mol
本题解析:
本题难度:一般
4、填空题 (16分)碳及其化合物应用广泛。
I 工业上利用CO和水蒸汽反应制氢气,存在以下平衡:
CO(g)+H2O(g)  CO2(g)+H2(g)△H>0
CO2(g)+H2(g)△H>0
(1)向1L恒容密闭容器中注入CO(g)和H2O(g),830℃时测得部分数据如下表。则该温度下反应的平衡常数K=______________。
(2)相同条件下,向1L恒容密闭容器中,同时注入2mol CO、2mol H2O(g),1molCO2和1mo1H2,此时v(正 ) __________v(逆)(填“>”“=”或“<”)
(3)上述反应达到平衡时,要提高CO的转化率,可采取的措施是_______(填字母代号)。
A.升高温度
B.加入催化剂
C.增大压强
D.增加CO的浓度
E.及时分离出CO2
II 已知CO(g)+1/2 O2(g)=CO2(g) △H=一141 kJ·mol-1
2H2(g)+ O2(g)=2H2O(g) △H=一484 kJ·mol-1
CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(g) △H=一726 kJ·mol-1
(4)用CO(g)、H2(g)化合制得液态甲醇的热化学方程式为___________________________。
III某同学设计了一个甲醇燃料电池,并用该电池电解100mL一定浓度NaCl与CuSO4混合溶液,其装置如图: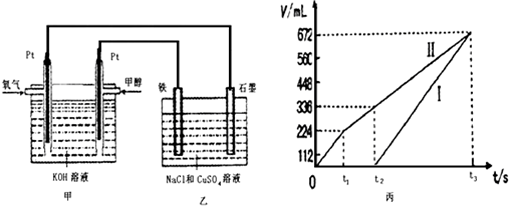
(5)写出甲中通入甲醇这一极的电极反应式__________________________________ 。
(6)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式____________,原混合溶液中CuSO4的物质的量浓度____________mol/L。(假设溶液体积不变)
(7)将在t2时所得的溶液稀释至200mL,该溶液的pH约为___________。
参考答案:(1) 1 (2分) (2)>(2分) (3)A E (2分)
(4)CO(g) + 2H2(g) ="=" CH3OH(1) △H=101 kJ·mol-1 (2分)
(5) CH3OH -- 6e- + 8OH- ="=" CO32-+ 6H2O (2分)
(6) 4OH--4e-=2H2O+O2↑ 或 2H2O-4e-=4H++O2↑(2分) 0.2(2分)
(7)1 (2分)
本题解析:(1)CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
起始物质的量 0.200 0.300 0 0
改变物质的量 0.12 0.12 0.12 0.12
平衡时物质的量 0.08 0.18 0.12 0.12
平衡常数=0.12×0.12/0.08×0.18=1.(2)Qc=1×1/2×2=0.25<1,所以反应向正向进行,所以正反应速率大于逆反应速率。(3)提高一氧化碳的转化率,要是平衡正向移动,所以可以升温,或及时分离出二氧化碳。选AE。加入催化剂不改变物质的转化率,增大压强,平衡不移动,不影响转化率,增加一氧化碳的浓度,转换率降低。(4)将反应标记为①②③,根据盖斯定律,①+②-③,得热化学方程式为:CO(g) + 2H2(g) ="=" CH3OH(1) △H=101 kJ·mol-1 。(5)甲中通入甲醇的一极,为原电池的负极,在碱性条件下,CH3OH -- 6e- + 8OH- ="=" CO32-+ 6H2O ,(6)乙为电解池,石墨电极连接原电池的正极,为电解池的阳极,刚开始电解产生氯气,后产生氧气,铁为阴极,刚开始铜离子放电,所以根据丙图,Ⅰ为阴极产生的气体,Ⅱ为阳极产生的气体,t1后,石墨电极上是产生氧气的电极反应:4OH--4e-=2H2O+O2↑ 或 2H2O-4e-=4H++O2↑。由图像知得到224毫升的氯气,转移电子0.02摩尔,产生了336-224=112毫升氧气,转移电子0.005×4=0.02摩尔,所以根据电子守恒,铜离子的物质的量=(0.02+0.02)/2=0.02摩尔,所以铜离子浓度=0.02/0.1=0.2mol/L。(7)根据2H2O-4e-=4H++O2↑,产生112毫升氧气,产生了0.02摩尔的氢离子,故氢离子浓度=0.02/0.1=0.1mol/L,所以pH=1.
考点:化学平衡常数,浓度积和反应进行的方向,化学平衡移动,原电池和电解池原理的应用。
本题难度:困难
5、选择题 下列有关电化学的图示,完全正确的是
参考答案:D
本题解析:A.是原电池。由于金属活动性Zn>Cu,所以Zn作负极,Cu作正极。在正极上发生还原反应产生氢气,电极判断不对,错误;B.在铜的精炼中,精铜作阴极,粗铜作阳极,含有Cu2+的盐溶液如CuSO4溶液作电解质溶液,铜的连接不对,错误;C.该装置是电镀,在铁片上镀锌,应该把镀件Fe片作阴极,把Zn片作阳极,含有Zn2+的溶液作电镀溶液,金属片与电源的连接不对,错误;D.电解饱和NaCl溶液,在阳极发生反应:Cl--2e-=Cl2↑,Cl2有氧化性,会把KI中的I-氧化为I2,于淀粉溶液变为蓝色,在阴极发生反应:2H++2e-=H2↑,H2的密度比空气小,用向下排空气的方法收集。由于H+放电,破坏了水的电离平衡,水继续电离,最终当达到平衡时,附近的溶液c(OH-)>c(H+),溶液显碱性,
考点:考查原电池、电解池的反应原理及应用的知识。
本题难度:一般