时间:2020-07-08 00:46:46
1、选择题 化学科学需要借助化学专用语言来描述,下列化学用语的书写正确的是( )
A.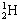
B.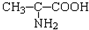
C.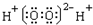
D.OHCCHO
2、选择题 物质的下列性质不能用键能来解释的是( )
A.氮气的化学性质没有氯气活泼
B.HF比HCl稳定
C.金刚石的熔点比晶体硅高
D.常温下溴呈液态,碘呈固态
3、填空题 (1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下表:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1 817 | 2 745 | 11 578 |
| Y | 738 | 1 451 | 7 733 | 10 540 |
| Z | 496 | 4 562 | 6 912 | 9 543 |
4、填空题 (12分)A、B、C、D、E五种均为短周期元素,原子序数依次增大。A元素原子最外层电子数是核外电子层数的3倍,A与D同主族,A和D可形成化合物X’X可以使溴水褪色。A元素的单质和C元素的单质化合可生成Y, Y晶体中无分子,也无A、C的离子。A、B元素的单质一定条件下反应生成化合物M,D、B元素的单质反应生成化合物N,化合物M和化合物N的相对分子质量相等,且馅色反应均呈黄色。
请回答下列问题:
(1) 元素C的气态氢化物是________分子(填写“极性”或“非极性”)。
(2) B2D2的电子式是________________
(3) X可以使溴水褪色,该反应的离子方程式是________________________。
(4) 化合物M与化合物N的水溶液反应,若氧化剂与还原剂物质的量之比为1: 1,该反应的离子方程式是________
(5) 右图是BE晶体的一个“晶胞结构”示意图。下列说法正确的是________________。 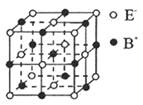
A.?与B+距离相等且最近的E_共有6个
B.?—个BE晶胞中含有1个B +和1个E_
C.?与B+距离相等且最近的B+有8个
D.?与B+距离相等且最近的构成的空间结构是正八面体
(6) 将原子序数介于B、C两元素之间的单质、单质B与水反应所得的溶液构成原电池,负极的电极反应式是:O
5、选择题 铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期.Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag=Tl++2Ag+.下列推断正确的是( )
A.Tl+的最外层有1个电子
B.Tl3+的氧化性比Al3+弱
C.Tl能形成+3价和+1价的化合物
D.Tl+的还原性比Ag强