时间:2020-07-08 00:46:46
1、选择题 下列用电子式表示化合物的形成过程,正确的是
[? ]
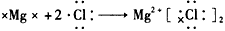
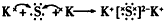
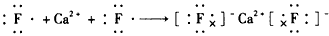
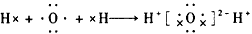
参考答案:B
本题解析:
本题难度:简单
2、填空题 (13分)A、B、C、D、E是元素周期表中前四周期常见元素,其原子序数依次增大。已知:
| A | 单质在自然界中硬度最大 |
| B | 原子中s能级与p能级电子数相等且有单电子 |
| C | C同在B的下一周期,C的电离能数据(kJ ·mol-1)为:I1=738? I2=1451? I3=7732? I4=10540 |
| D | 单质密度小,较好的延展性,广泛用于食品包装,D的氧化物是两性氧化物 |
| E | 单质是一种常见金属,与O元素能形成黑色和砖红色两种氧化物 |
参考答案:((1)、方程式、电极反应式,每空2分,其余每空1分)
(1)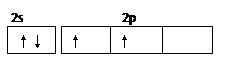 Al + 4OH- -3e- =AlO2- +2H2O?
Al + 4OH- -3e- =AlO2- +2H2O?
(2) 2? O—H?1327Al? 13?
(3)高?水分子之间存在氢键
(4)2Mg(s)+CO2(g) =" 2MgO(s)" + C(s)?ΔH = -(2b—a) kJ?mol-1
本题解析:根据元素的结构及有关性质可知,A、B、C、D、E分别是C、O、Mg、Al、Fe。
(1)根据构造原理可知,C元素基态原子的价电子排布图是 ;由于镁和氢氧化钠溶液不反应,铝能和氢氧化钠溶液反应,所以在该原电池中镁是正极,铝是负极,负极反应式是Al + 4OH- -3e- =AlO2- +2H2O。
;由于镁和氢氧化钠溶液不反应,铝能和氢氧化钠溶液反应,所以在该原电池中镁是正极,铝是负极,负极反应式是Al + 4OH- -3e- =AlO2- +2H2O。
(2)气态单质甲分子与CO分子核外电子数相等,所以甲是氮气。氮气中含有三键,而三键是由2个π键和1个α键形成的;由于氧元素的非金属性其余碳元素的,所以键的极性较强的是O-H键;由于质子数和中子数之和是质量数,所以根据题意可知,该原子的符号是1327Al;核外电子数是13个,则就有13种运动状态不同的电子。
(3)由于水分子之间存在氢键,所以其熔沸点高于硫化氢的。
(4)根据燃烧热可知,热化学方程式是① c(s)+O2(g)=CO2(g)?△H=-a kJ ·mol-1,② Mg(s)+1/2O2(g)=2MgO(s)?△H=-bkJ ·mol-1。所以根据盖斯定律可知,②×2-①即得到2Mg(s)+CO2(g) =" 2MgO(s)" + C(s),所以反应热ΔH = -(2b—a) kJ?mol-1。
本题难度:一般
3、选择题 白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为: P—P a kJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。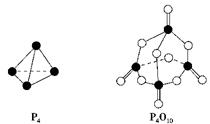
根据下图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A.(4c+12b-6a-5d)kJ·mol-1
B.(6a+5d-4c-12b)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1
D.(4a+5d-4c-12b)kJ·mol-1
参考答案:B
本题解析:反应热就是断键吸收的能量和形成化学键放出的能量的差值。根据结构示意图可知△H=(6a+5d-4c-12b)kJ/mol,所以答案选B。
本题难度:简单
4、填空题 . (6分)碳族元素包括C、Si、Cu、Sn、Pb。
(1)碳纳米管由单层或多层石墨卷曲而成,其结构类似于石墨晶体,每个碳原子通过?杂化与周围碳原子成键,多层碳纳米管的层与层之间靠?结合在一起。
(2)CH4中共用电子对偏向C、SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为?。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br键的键角?120°(填“>”“<”或“=”)
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心。该化合物化学式为?,每个Ba2+与?个O2-配位。
参考答案:(每空1分,共6分)(1)sp2?分子间作用力(或:范德华力)
(2)C>H>Si?(3)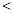 ?(4)BaPbO3? 12
?(4)BaPbO3? 12
本题解析:(1)石墨属于层状结构,同一层内碳元素是通过sp2杂化与其它碳原子成键。而层与层之间通过分子间作用力结合在一起。
(2)元素电负性越强,共用电子对就偏向该原子不少于根据题意可知,C、Si、H的电负性由大到小的顺序为C>H>Si 。
(3)根据价层电子对互斥理论可知,中心原子含有的孤对电子是(4-1×2)÷2=1,所以其键角小于120°。
(4)Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,所以每个Ba2+与12个O2-配位,则晶胞中Pb4+的个数为8×1/8=1、Ba2+是1个、O2-是12×/14=3,所以化学式为BaPbO3。
本题难度:一般
5、推断题 A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D、E是第四周期元素,其中E元素的核电荷数为29。D原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为?。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为?,1mol该分子中含有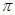 键的数目为?。
键的数目为?。
(3)基态D原子的外围电子排布式为?。DO2Cl2熔点:-96 .5℃,沸点:117℃,则固态DO2Cl2属于?晶体。
(4)E的氢化物的晶胞结构如图所示,其化学式是?。 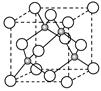 ?
?
参考答案:(12分)
A:(1)C<O<N(2分)
(2)N≡C-C≡N (2分)? 4NA(或2.408×1024)(2分)
(3)3d54s1(2分) 分子(2分)
(4)CuH(2分)
本题解析:A为C、B为N,C为O,D是Cr,E为Cu,⑴同一周期第一电离能由小变大,其中N的2P轨道是半满状态,第一电离能变大,答案:C<O<N;CN―与N2为等电子体,C与N之间形成叁键,结构式为N≡C-C≡N,其中每个分子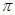 键的数目为4个,答案:N≡C-C≡N 、 4NA(或2.408×1024);⑶注是要求写D原子的外围电子排布式3d54s1,DO2Cl2熔点、沸点低,符合分子晶体的性质,答案:3d54s1、 分子;⑷由图晶胞中Cu为8×1/8+6×1/2=4,H为4,是离子化合物,化学式为CuH,答案:CuH。
键的数目为4个,答案:N≡C-C≡N 、 4NA(或2.408×1024);⑶注是要求写D原子的外围电子排布式3d54s1,DO2Cl2熔点、沸点低,符合分子晶体的性质,答案:3d54s1、 分子;⑷由图晶胞中Cu为8×1/8+6×1/2=4,H为4,是离子化合物,化学式为CuH,答案:CuH。
本题难度:一般