时间:2020-07-08 00:45:01
1、选择题 常温下,将0.01 mol·L-1 Na2SO3溶液与0.01 mol·L-1 KHSO3溶液等体积混合,若忽略混合后溶液的体积的变化,则下列判断正确的量(? )
A.混合后溶液中存在有关系:C(K+)+C(Na+)+C(H+)=C(SO32-)+C(HSO3-)+C(OH-)
B.混合后溶液中存在有关系:C(K+)+C(H2SO3)+C(H+)=C(SO32-)+C(OH-)
C.混合后溶液中存在有关系:C(SO32-)+C(HSO3-)+C(H2SO3)=0.02 mol/L
D.两溶液混合前,Na2SO3溶液中,水电离出C(H+)小于KHSO3溶液中水电离出C(H+)
参考答案:B
本题解析:A.根据电荷守恒可得C(K+)+C(Na+)+C(H+)=2C(SO32-)+C(HSO3-)+C(OH-).错误。B.根据电荷守恒可得C(K+)+C(Na+)+C(H+)=2C(SO32-)+C(HSO3-)+C(OH-);根据微粒的物质的量的关系可得C(Na+) =C(SO32-)+C(HSO3-) +C(H2SO3)。代入第一个式子,整理可得C(K+)+C(H2SO3)+C(H+)=C(SO32-)+C(OH-)。正确。C.混合后溶液中的微粒根据物料守恒关系可知: C(SO32-)+C(HSO3-)+C(H2SO3)=(0.01+0.01)÷2="0.01" mol/L.错误。D.两溶液混合前,在Na2SO3溶液中,由于SO32-是H2SO3二级电离产生的离子,而KHSO3溶液中HSO3-是H2SO3一级电离产生的离子,所以SO32-一级水解水解程度大于二级HSO3-的水解程度。水解程度越大,水电离产生的离子浓度越大。因此两溶液混合前,Na2SO3溶液中,水电离出C(H+)大于KHSO3溶液中水电离出C(H+)。错误。
本题难度:一般
2、填空题 (14分)化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)  2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示: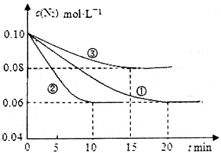
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=__________________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的__________、__________(填字母编号)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)="0.05" mol/L,则该反应的平衡常数K=_______________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将_____________(填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。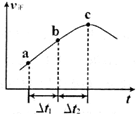
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a______b。 (填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数Kb=________________。
H2O的电离平衡常数Kb=________________。
参考答案:(14分)(1)0.008mol/(L·min)(2分);E(1分);C(1分)
(2)①5L/mol(2分) ②减小(2分),③C(2分);
(3)>(2分) 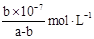 (2分)
(2分)
本题解析:(1)根据图示可知实验②从初始到平衡的过程中,该反应的平均反应速率v(N2)=(0.1mol/L-0.06mol/L)÷10min=0.004mol/(L·min),由于v(NH3):v(N2)=2:1,所以v(NH3)="2" v(N2)=0.008mol /(L·min);与实验①相比,实验②达到平衡所需要的时间短,反应速率快,而物质的平衡浓度没有变化,说明平衡没有发生移动,则所改变的实验条件是加入催化剂,选项是E;而实验③达到平衡所需要的时间短,反应速率快,而物质N2的平衡浓度比①高,说明平衡向逆反应方向移动,所改变的实验条件是升高温度,选项是C;(2)已知NO2与N2O4可以相互转化:2NO2(g)  N2O4(g)。①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,在反应开始时c(NO2)=0.20mol/L.达到平衡后,测得容器中c(N2O4)="0.05" mol/L,根据方程式中物质反应的关系可知,消耗?c(NO2)=0.10mol/L.,所以c(NO2)(ph)=0.10mol/L.则该反应的平衡常数K=
N2O4(g)。①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,在反应开始时c(NO2)=0.20mol/L.达到平衡后,测得容器中c(N2O4)="0.05" mol/L,根据方程式中物质反应的关系可知,消耗?c(NO2)=0.10mol/L.,所以c(NO2)(ph)=0.10mol/L.则该反应的平衡常数K=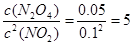 (mol/L);②已知N2O4在较高温度下难以稳定存在,易转化为NO2,说明升高温度,平衡逆向移动,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,正反应是放热反应。则升高温度上述反应的平衡常数K将减小;③A.根据图像可知正反应速率随时间的延长而升高,说明反应正向进行,反应在c点时显示的速率最大,但此时反应可能处于平衡状态,也可能未达到判断,延长不能判断反应是否处于平衡状态,错误;B.由于反应是从正反应方向开始的,所以反应物的浓度会逐渐减小,当达到平衡时达到最小值,所以反应物浓度:a点大于b点,错误;C.由于正反应是放热反应,所以Δt1=Δt2时,温度在b~c段高于a~b段,因为温度对速率的影响大于浓度的影响,所以NO2的转化率:a~b段小于 b~c段,正确。(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,若二者的物质的量相等,则反应恰好产生NH4Cl,该盐是强酸弱碱盐,水解使溶液显酸性,若反应后溶液恰好显中性,则氨水应该稍微过量,所以a>b;NH3·H2O
(mol/L);②已知N2O4在较高温度下难以稳定存在,易转化为NO2,说明升高温度,平衡逆向移动,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,正反应是放热反应。则升高温度上述反应的平衡常数K将减小;③A.根据图像可知正反应速率随时间的延长而升高,说明反应正向进行,反应在c点时显示的速率最大,但此时反应可能处于平衡状态,也可能未达到判断,延长不能判断反应是否处于平衡状态,错误;B.由于反应是从正反应方向开始的,所以反应物的浓度会逐渐减小,当达到平衡时达到最小值,所以反应物浓度:a点大于b点,错误;C.由于正反应是放热反应,所以Δt1=Δt2时,温度在b~c段高于a~b段,因为温度对速率的影响大于浓度的影响,所以NO2的转化率:a~b段小于 b~c段,正确。(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,若二者的物质的量相等,则反应恰好产生NH4Cl,该盐是强酸弱碱盐,水解使溶液显酸性,若反应后溶液恰好显中性,则氨水应该稍微过量,所以a>b;NH3·H2O NH4++OH-;当达到电离平衡时c(NH3·H2O)=(a-b)mol/L,c(OH-)=10-7mol/L,所以NH3
NH4++OH-;当达到电离平衡时c(NH3·H2O)=(a-b)mol/L,c(OH-)=10-7mol/L,所以NH3 H2O的电离平衡常数Kb=
H2O的电离平衡常数Kb=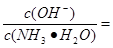
 。
。
考点:考查化学反应速率的计算、、化学平衡状态的判断、影响化学平衡的因素、物质的电离平衡产生的表达式的书写的知识。
本题难度:困难
3、选择题 在甲酸的下列性质中,可以证明它是弱电解质的是( )
A.1mol/L的甲酸溶液中c(H+)约为1×10-2?mol/L
B.甲酸能与水以任意比例互溶
C.1mol/L的甲酸溶液10mL恰好与10mL1mol/L的NaOH溶液完全反应
D.在相同条件下,甲酸溶液的导电性比盐酸弱
参考答案:A、甲酸是一元酸,酸浓度大于氢离子浓度,说明甲酸不能完全电离,肯定是弱电解质,故A正确;
B、溶解性与电解质强弱无关,故B错误;
C、完全反应与强弱无关,故C错误;
D、在相同条件弱电解质部分电离,溶液中离子少,导电性弱于强电解质,故D正确.
故选AD.
本题解析:
本题难度:一般
4、填空题 (2分).写出下列物质的电离方程式
(1)H2CO3
(2)KNO3
参考答案:(1)H2CO3 . 2H++HCO3- (2)KNO3 =K++NO3-
. 2H++HCO3- (2)KNO3 =K++NO3-
本题解析: (1)碳酸是弱电解质,所以能部分电离出氢离子和碳酸氢根离子,故写成: H2CO3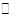 2H++HCO3
2H++HCO3
本题难度:一般
5、选择题 已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 电离平衡常数(25℃) 1.8×l0-5 4.9×l0-10 K1=4.3×l0-7 K2=5.6×l0-11 |
参考答案:C
本题解析:
本题难度:一般