时间:2020-07-08 00:45:01
1、选择题 某探究小组在某温度下测定溶液的pH时发现:0.01mol·L-1的NaOH溶液中,由水电离出的
c(H+)·c(OH-)=10-22,则该小组在该温度下测得0.1mol·L-1NaOH溶液的pH应为
A.13
B.12
C.11
D.10
2、选择题 已知下表为250C时某些弱酸的电离平衡常数。下图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。依据所给信息,下列说法正确的是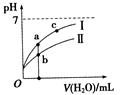
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7?Ka2=4.7×10-11 |
3、填空题 (6分)设水的电离平衡线如右图所示。 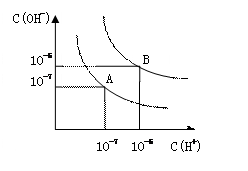
(1)若以A点表示25℃时水在电离平衡时的粒子浓度,当温
度升高到100℃时,水的电离平衡状态到B点,则此时水的离子
积从___________增加到____________; A
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持
在100℃的恒温,欲使混合溶液的PH=7,则Ba(OH)2溶液和盐
酸的体积比为__________。
4、选择题 在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH≒CH3COO-+H+?对于该平衡,下列叙述正确的是
A.加入水时,平衡向电离方向移动,pH减小
B.加入少量NaOH固体,平衡向电离方向移动
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小[
D.加入少量CH3COONa固体,平衡向电离方向移动
5、选择题 物质的量浓度相同的下列各溶液,由水电离出的氢氧根浓度由大到小的顺序是( )
①NaHSO4②NaHCO3③Na2CO3④Na2SO4.
A.④③②①
B.①②③④
C.③②④①
D.③④②①