时间:2020-07-08 00:32:13
1、选择题 V L硫酸铝溶液中含Al3+的质量为m g,则溶液中SO42-的物质的量浓度为:
A.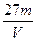 mol·L-1
mol·L-1
B.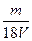 mol·L-1
mol·L-1
C.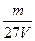 mol·L-1
mol·L-1
D.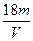 mol·L-1
mol·L-1
参考答案:B
本题解析:略
本题难度:一般
2、选择题 下列溶液中Cl-的物质的量浓度最大的是
A.200 mL 2 mol·L-1 MgCl2溶液
B.1000 mL 2.5mol·L-1NaCl溶液
C.250 mL 1 mol·L-1 AlCl3溶液
D.300 mL 5 mol·L-1 KClO3溶液
参考答案:A
本题解析:根据物质的化学式及物质的物质的量浓度来计算氯离子的物质的量浓度,A. 2 mol·L-1 MgCl2溶液中氯离子的物质的量浓度为2mol/L×2=4mol/L;B. 2.5 mol·L-1 NaCl溶液中氯离子浓度为2.50mol/L×1=2.5mol/L;C、1 mol·L-1 AlCl3溶液中氯离子浓度为1mol/L×3=3mol/L;D. KClO3溶液中没有氯离子;选A。
考点:考查离子浓度的计算。
本题难度:简单
3、选择题 2molCl2和2molCO2相比较正确的是
A.分子数相等
B.原子数相等
C.体积相等
D.质量相等
参考答案:A
本题解析:根据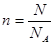 可知,在相同条件下,相同物质的量的任何气体含有相同的分子数,即选项A正确。氯气和CO2的原子数不同,摩尔质量也不同,BD都不正确。由于温度和压强不一定相同,所以体积不一定相同,C也不正确。答案选A。
可知,在相同条件下,相同物质的量的任何气体含有相同的分子数,即选项A正确。氯气和CO2的原子数不同,摩尔质量也不同,BD都不正确。由于温度和压强不一定相同,所以体积不一定相同,C也不正确。答案选A。
本题难度:一般
4、选择题 用NA表示阿伏加德罗常数,下列说法正确的是
A.2g氢气所含原子数目为NA
B.1.7g NH3中含N—H键数目为0.1NA
C.标准状况下,22.4L单质溴所含有的原子数目为2NA
D.1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
参考答案:D
本题解析:略
本题难度:简单
5、填空题 (4分)现有m g某气体,它由四原子分子构成,它的摩尔质量为M g/mol.则:
(1)该气体的物质的量为________mol。
(2)该气体中所含的原子总数约为 个。
(3)该气体在标准状况下的体积为________L。
(4)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为________mol/L。
参考答案:(每空1分,共4分) (1) 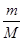 (2)
(2) 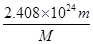 (3)
(3)  (4)
(4) 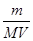
本题解析:考查物质的量的有关计算。
(1)根据n=m/M可知,该气体的物质的量为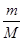 mol。
mol。
(2)该气体是由4个原子构成的,所以该气体中所含的原子总数约为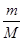 mol×4×6.02×1023/mol=
mol×4×6.02×1023/mol=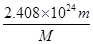 个。
个。
(3)根据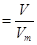 可知,该气体在标准状况下的体积为
可知,该气体在标准状况下的体积为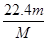 L。
L。
(4)根据c=n/V可知,该气体溶于水后形成V L溶液,其溶液的物质的量浓度为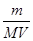 mol/L。
mol/L。
本题难度:一般