时间:2020-07-08 00:32:13
1、选择题 V L硫酸铝溶液中含Al3+的质量为m g,则溶液中SO42-的物质的量浓度为:
A.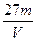 mol·L-1
mol·L-1
B.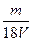 mol·L-1
mol·L-1
C.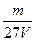 mol·L-1
mol·L-1
D.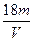 mol·L-1
mol·L-1
2、选择题 下列溶液中Cl-的物质的量浓度最大的是
A.200 mL 2 mol·L-1 MgCl2溶液
B.1000 mL 2.5mol·L-1NaCl溶液
C.250 mL 1 mol·L-1 AlCl3溶液
D.300 mL 5 mol·L-1 KClO3溶液
3、选择题 2molCl2和2molCO2相比较正确的是
A.分子数相等
B.原子数相等
C.体积相等
D.质量相等
4、选择题 用NA表示阿伏加德罗常数,下列说法正确的是
A.2g氢气所含原子数目为NA
B.1.7g NH3中含N—H键数目为0.1NA
C.标准状况下,22.4L单质溴所含有的原子数目为2NA
D.1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子
5、填空题 (4分)现有m g某气体,它由四原子分子构成,它的摩尔质量为M g/mol.则:
(1)该气体的物质的量为________mol。
(2)该气体中所含的原子总数约为 个。
(3)该气体在标准状况下的体积为________L。
(4)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为________mol/L。