时间:2020-07-08 00:25:47
1、选择题 向某无色溶液中加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀,则溶液中含有的离子是
A.一定有 CO32-
B.一定有Ag+
C.一定有SO42-
D.无法确定
参考答案:D
本题解析:加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀,沉淀可能为氯化银或者硫酸钡。溶液中含有的离子是SO42-或Ag+或二者皆有。故选D
点评:掌握常见离子的检验。注意其他离子的干扰情况。
本题难度:一般
2、选择题 用下图所示方法,检验某固体中是否含有Cl—,下列说法正确的是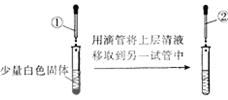
A.①是BaCl2溶液,②稀盐酸
B.①是稀盐酸,②稀BaCl2溶液
C.①是稀硝酸,②是AgNO3溶液
D.①是稀硫酸,②是AgNO3溶液
参考答案:C
本题解析:略
本题难度:简单
3、选择题 由H79Br和H81Br组成的混合气体对N2的相对密度为2.9,则气体中79Br和81Br的原子个数比为
A.1:1
B.1:2
C.2:3
D.3:2
参考答案:C
本题解析:分析:根据ρ=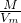 知,相同条件下,两种气体的密度之比等于其相对分子质量之比,所以H79Br和H81Br组成的混合气体的平均摩尔质量为81.2,再利用十字相乘法计算79Br和81Br的原子个数比.
知,相同条件下,两种气体的密度之比等于其相对分子质量之比,所以H79Br和H81Br组成的混合气体的平均摩尔质量为81.2,再利用十字相乘法计算79Br和81Br的原子个数比.
解答:根据ρ=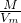 知,相同条件下,两种气体的密度之比等于其相对分子质量之比,所以H79Br和H81Br组成的混合气体的平均摩尔质量为81.2,则79Br和81Br的平均相对原子质量为80.2,
知,相同条件下,两种气体的密度之比等于其相对分子质量之比,所以H79Br和H81Br组成的混合气体的平均摩尔质量为81.2,则79Br和81Br的平均相对原子质量为80.2,
,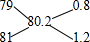 79Br和81Br物质的量之比为0.8:1.2=2:3,其原子个数之比为2:3,故选C.
79Br和81Br物质的量之比为0.8:1.2=2:3,其原子个数之比为2:3,故选C.
点评:本题考查了利用平均相对原子质量计算原子个数之比,难度不大,利用十字相乘法进行计算即可.
本题难度:简单
4、选择题 在pH为4-5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀。工业上制CuCl2是将浓盐酸用蒸汽加热到80℃ 左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法中可行的是
[? ]
A.加入纯Cu将Fe2+还原
B.在溶液中通入Cl2,再加入CuO粉末调节pH为4~5
C.向溶液中通入H2S使Fe2+沉淀
D.在溶液中通入Cl2,再通入NH3调节pH为4-5
参考答案:B
本题解析:
本题难度:一般
5、填空题 为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |


参考答案:(15分)(1)V2O5(1分)(2)VOSO4(2分)(3)NH4++VO3- =NH4VO3↓(2分);
4(2分);80(2分) (4)2(2分);2(2分) (5)VO2++ 2H++e-= VO2++H2O(2分)
本题解析:(1)铝和五氧化二钒发生铝热反应的方程式为:3V2O5+10Al 6V+5Al2O3,反应中氧化剂是V2O5;
6V+5Al2O3,反应中氧化剂是V2O5;
(2)根据溶解性表知,V2O5难溶,VOSO4可溶,因此滤渣是V2O5,滤液中含矾的主要成分的化学式为VOSO4;
(3)根据NH4VO3难溶可知,反应③是复分解反应,方程式为NH4++VO3- =NH4VO3↓;根据图像可知氯化铵系数为4、温度为80℃时沉淀率最高,所以最佳控制氯化铵系数和温度为4和80℃。
(4)根据方程式2VO2++H2C2O4+2H+=2VOn+ + 2CO2↑+ mH2O可知草酸中碳元素的化合价从+3价升高到+4价,失去1个电子,1mol草酸失去2mol电子,则根据电子得失守恒可知氧化剂得到2mol电子,所以1mol VO2+得到1mol电子,V元素的化合价从+5价降低+4价,因此n=2;根据氢原子守恒可知m=2。
(5)放电是原电池,正极得到电子,则根据总反应式可知,放电时VO2+得到电子,电极反应式为 VO2++ 2H++e-=VO2++H2O。
本题难度:一般