时间:2020-07-08 00:11:41
1、填空题 已知A、B、C、D均是元素周期表中前36号中的元素,其原于序数依次递增,其他相关结构或性质信息如下表。
| 元素 | 结构或性质信息 |
| A | 原子核外有一个未成对电子,其氢化物与水分子间能形成氢键 |
| B | 原子核外M层电子数是N层电子数的4倍 |
| C | 是使用最为广泛的合金的主要成分 |
| D | 原子各内层电子均已饱和,最外层电子数为1 |
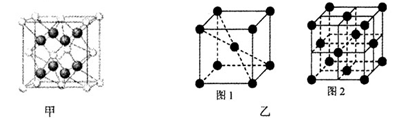
2、计算题 已知甲烷分子中相邻两氢原子间距离为a,求其键长和键角。
3、选择题 非金属元素A与金属元素B的离子具有相同电子层结构,原子半径B>A,它们可形成离子化合物B2A,由此下列正确判断是( )
A.A可能在第3周期ⅥA族
B.B+离子半径大于A2-离子半径
C.A的电负性大于B的电负性
D.A的第一电离能小于B的第一电离能
4、选择题 NH3、H2S等是极性键构成的极性分子,CO2、BF3、CCl4等是极性键构成的非极性分子。根据上述事实,通过比较归纳可推出ABn型分子是非极性分子的经验规律是
[? ]
A.分子中不含有H原子的分子是非极性分子
B.在ABn分子中A原子的所有价电子都参与成键的是非极性分子
C.ABn分子中每个共价键的键长都相等的分子是非极性分子
D.在ABn分子中A的相对原子质量小于B的相对原子质量时为非极性分子
5、填空题 a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子分子;试写出:
(1)写出下列粒子的电子式: ①c__________;②d__________;③e__________;④a__________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:__________>__________(用化学式表示)。
(3)用电子式表示b元素与氧形成的化合物b2O的形成过程:_______________________________。