时间:2020-07-08 00:11:41
1、选择题 下列分子中,没有非极性键的化合物的是(?)
A.H2
B.CO2
C.H2O2
D.C2H4
参考答案:B
本题解析:略
本题难度:简单
2、选择题 下列含有同一元素的含氧酸中酸性强弱比较正确的是( )?
A.H2SO3>H2SO4?
B.HNO3>HNO2?
C.H3PO3>HPO3?
D.HClO>HClO4
参考答案:BC?
本题解析:同种元素的不同价态的无机含氧酸,价态越高,酸性越强。?
本题难度:简单
3、选择题 下列性质符合分子晶体的是:?
A.熔点1070℃,易溶于水,水溶液能导电
B.熔点是10.31℃,液体不导电,水溶液能导电
C.熔点97.81℃,质软,能导电,密度是0.97g/cm3
D.熔点781℃,熔化时能导电,水溶液也能导电
参考答案:B
本题解析:分子晶体的熔点低,液态条件下没有能够自由移动的离子所以液态条件下不导电,据此判断B正确。
本题难度:简单
4、选择题 下列说法中,正确的是
[? ]
A.酸性:盐酸>氢硫酸(H2S),故非金属性:Cl>S
B.第二周期元素的最高正化合价从左到右依次升高
C.共价化合物中只存在共价键离子化合物中一定含有离子键
D.元素原子的最外层电子数越多,得电子能力越强,失电子能力越弱
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列表示物质结构的化学用语或模型图正确的是(? )
A.氯化铵(NH4Cl)的电子式: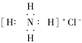
B.H2O2的电子式: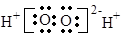
C.HClO的结构式:H-O-Cl
D.14C的原子结构示意图: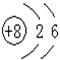
参考答案:C
本题解析:选项A错误,氯化铵(NH4Cl)的电子式为: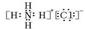 ;选项B错误,H2O2的电子式为
;选项B错误,H2O2的电子式为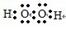 ;选项D错误,14C的原子结构示意图:
;选项D错误,14C的原子结构示意图: ;故选C。
;故选C。
点评:电子式、原子结构示意图是历年高考的“热点”问题,这是由于它既考查了学生对物质的结构、粒子数等的理解,又可以涵盖多角度的化学知识内容。要准确解答好这类题目,一是要掌握好以物质的结构为中心的各化学量的关系;二是要准确弄清分子、原子、原子核内质子及核外电子之间的构成关系。
本题难度:简单