时间:2020-07-08 00:03:00
1、填空题 在一定条件下进行下列化学反应,请根据以下的转化关系回答下列问题,已知A、B、C中均含有同一种元素.已知: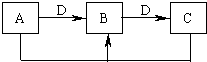
①若D为金属单质,且以上反应均为氧化还原反应,请写出检验B中阳离子的一种方法______.
②若D为碱,且以上反应均为非氧化还原反应,则A、B、C、D分别可以是:(按顺序写出合理的一组物质的化学式即可)A______,B______,C______,D______.
③D为碱时,写出A和C反应的离子方程式______.
2、推断题 A~G为中学化学中常见的物质,B、E、F为单质,在常温下B是一种有色气体,G为黑色的固体。它们的相互转化如图所示,部分生成物未列出。试回答下列问题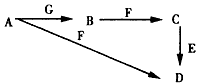
(1)写出下列物质的化学式:A________、G_________。
(2)F的一种氧化物常用作红色油漆和涂料,这种氧化物的俗称为________。
(3)E在电气、电子工业应用最广,也是人类发现最早的金属之一。写出E与C反应的离子方程式_______________________,利用电解法可提纯E物质,在该电解反应中阳极物质是______,阴极物质是______,电解质溶液是_________。
(4)将B与SO2等体积混合后,通入品红溶液中,观察到的现象是______________,涉及的化学方程式为
__________________,工业上获得B的重要途径是___________________(用化学方程式表示)。
3、推断题 A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。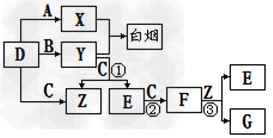
请回答下列问题:
(1)D的化学式为__________________;
(2)反应③的离子方程式为____________________。
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为__________________。
(4)0.1mol/L的X溶液和0.1mol/L的Y溶液等体积混合,溶液呈________性;(填“酸”、“碱”或“中”)该溶液中各离子浓度大小关系为:_______________________
(5)常温下0.1mol/L的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是_________
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1?L与该0.1mol/L的Y溶液V2?L混合,若混合溶液pH=7,则:V1>V2
E.将pH=11的Y溶液加水稀释100倍后,pH值为9
(6)化合物E在一定条件下于一定体积的容器中可发生身氧化还原反应,测得容器内气体的压强略小于原来的2/3,请写出该反应的化学方程式____________________
4、选择题 下列各组物质中,前者是单质,后者是氧化物的是
A.尿素、赤铁矿石
B.金刚石、水
C.液氧、氯酸钾
D.汞、碘酒
5、填空题 已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系: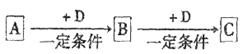
(1)若A能使湿润的红色石蕊试纸变蓝,C为红棕色气体。则实验室常用的制取A的化学方程式为?,A转化为B的化学方程式为?。
(2)若组成D单质的元素在地壳中含量最高,A元素焰色反应为黄色,则C的电子式为?。
(3)若D是金属,C溶液在贮存时应加入少量D,其理由是(只用离子方程式说明)________________,A与D反应的化学方程式是?。
(4)若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为?。
(5)若D为一种强碱,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为?。