时间:2020-07-08 00:02:20
1、计算题 (4分)硝酸铜受热易分解:2Cu(NO3)2 ?2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO
?2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO  2Cu2O+ O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2
2Cu2O+ O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2 N2O4,2NO2=2NO+O2等反应)。
N2O4,2NO2=2NO+O2等反应)。
现取5.64gCu(NO3)2无水晶体,在一定温度下使其分解,将生成的气体及时导出并用足量的NaOH溶液充分吸收。
⑴若该质量的无水硝酸铜经加热完全分解,其中的铜元素全部转化为氧化铜,则氧化铜的质量是__________g。
⑵若该质量的无水硝酸铜完全分解,铜元素全部转化为氧化亚铜,反应过程中生成的气体被足量的NaOH溶液充分吸收后,还有多余的气体,则多余的气体是________(填分子式),其体积(标准状况)是_____________L。
⑶若该质量的无水硝酸铜分解后的残留固体中含有1.60g CuO,则残留固体的质量可能
是_________g。
参考答案:(1)2.4g(1分);⑵O2,0.168L(各1分,共2分);⑶3.48g或2.32g(共1分);
本题解析:(1)5.64gCu(NO3)2的物质的量是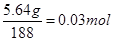 ,所以可以生成0.03mol氧化铜,质量是0.03mol×80g/mol=2.4g。
,所以可以生成0.03mol氧化铜,质量是0.03mol×80g/mol=2.4g。
(2)如果生成氧化亚铜,则方程式为4Cu(NO3)2 ?2Cu2O+8NO2↑+3O2↑.生成的气体溶于水发生反应的方程式为4NO2+O2+2H2O=4HNO3,所以氧气是过量的。0.03mol硝酸铜生成0.06molNO2和0.0225mol氧气,所以通入水后剩余氧气是0.0225mol-0.015mol=0.0075mol,标准状况下的体积是0.168L。
?2Cu2O+8NO2↑+3O2↑.生成的气体溶于水发生反应的方程式为4NO2+O2+2H2O=4HNO3,所以氧气是过量的。0.03mol硝酸铜生成0.06molNO2和0.0225mol氧气,所以通入水后剩余氧气是0.0225mol-0.015mol=0.0075mol,标准状况下的体积是0.168L。
(3)1.60g CuO是0.02mol。如果残留物是氧化铜和氧化亚铜构成的,则氧化亚铜的质量是0.005mol×144g/mol=0.72g,则总质量是2.32g;如果是氧化铜和硝酸铜构成的,则硝酸铜是0.01mol,质量是1.88g,则总质量是3.48g。
本题难度:一般
2、选择题 1mol?CO和1mol?CO2具有相同的:①分子数?②原子总数?③碳原子数?④氧原子数( )
A.①③
B.②④
C.①④
D.①②③
参考答案:A
本题解析:
本题难度:简单
3、选择题 将35.8g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44L NO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为
A.66.4 g
B.50.8 g
C.44.8g
D.39.2g
参考答案:B
本题解析:合金溶于足量的NaOH溶液中,金属铝和氢氧化钠反应产生气体氢气6.72L(标准状况),所以金属铝的质量是5.4g,金属铝失电子的量是0.6mol,将合金溶于过量稀硝酸中,分别生成Al3+、Fe3+、Cu2+离子,根据电子守恒,金属共失去电子的物质的量为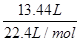 ×3=1.8mol,向反应后的溶液中加入过量的NaOH溶液,铝离子全部转化为偏铝酸根离子,不会出现沉淀,反应中金属铁、铜失去电子的物质的量1.2mol等于生成碱的氢氧根离子的物质的量,即n(OH-)=1.2mol,所以反应后沉淀的质量等于35.8g-5.4g+1.2mol×17g·mol-1=50.8 g.故选B.
×3=1.8mol,向反应后的溶液中加入过量的NaOH溶液,铝离子全部转化为偏铝酸根离子,不会出现沉淀,反应中金属铁、铜失去电子的物质的量1.2mol等于生成碱的氢氧根离子的物质的量,即n(OH-)=1.2mol,所以反应后沉淀的质量等于35.8g-5.4g+1.2mol×17g·mol-1=50.8 g.故选B.
本题难度:一般
4、选择题 用NA表示阿伏加德罗常数的值。下列说法正确的是(? )
A.32g O2中含有的分子数为NA
B.标准状况下,22.4 L H2O中含有的分子数为NA
C.1 mol Mg与足量O2反应转移的电子数为NA
D.1 L 1 mol·L-1 CaCl2溶液中含有的氯离子数为NA
参考答案:A
本题解析:32g O2为1mol,分子数为NA,A正确;标准状况下,水不是气体,B错误;镁与足量氧气反应,Mg失电子,1个Mg原子失去2个电子,C正确;1 L 1 mol·L-1 CaCl2溶液中含有的氯离子数为2mol,D错误。NA
点评:标准状况下,1mol任何气体的体积都约是22.4L,注意关键词:标准状况、1mol、气体、22.4L。
本题难度:一般
5、选择题 用NA表示阿伏加德罗常数的值,下列叙述不正确的是(?)。
A.标准状况下,22.4 L CO2含有的分子数为NA
B.将10.6 g Na2CO3溶于水,电离出Na+的数目为0.2 NA
C.1 mol CuO被还原成Cu,得到电子数目为2 NA
D.1 L 0.5 mol/L的FeCl3溶液中,含有Cl-数目为 0.5 NA
参考答案:D
本题解析:标准状况下,22.4LCO2的物质的量是22.4L÷22.4L/mol=1mol,A正确;10.6g碳酸钠的物质的量是10.6g÷106g/mol=0.1mol,溶于水电离出0.2mol钠离子,B正确;氧化铜中铜元素的化合价是+2价,生成物单质铜中化合价是0价,所以转移2个电子,C正确;D不正确,氯离子的物质的量是1L×0.5mol/L×3=1.5mol,即含有Cl-数目为 1.5 NA,答案选D。
点评:考查阿伏加德罗常数的应用的题目,为高考必考题目,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容。要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系。
本题难度:一般