时间:2020-07-07 23:57:47
1、计算题 (10分)取100mL的Na2CO3和Na2SO4混合溶液,加入足量Ba(OH)?2溶液,恰好完全反应,过滤、干燥后得到24.36g白色沉淀,再用过量稀硝酸处理沉淀,最后减少到4.66g,并有气体放出。计算:(请写出计算过程)?
(1)原混合液中Na2SO4的物质的量浓度为?
(2)产生的气体在标准状况下的体积为?
参考答案:(1)0.2molL-1
(2)2.24L
本题解析:略
本题难度:一般
2、选择题 在标况下,将V? L A气体(摩尔质量M g/mol)溶于1L水中,所得A的水溶液密度为ρg/cm3,则此溶液的物质的量浓度(mol/L)为?(?)
A.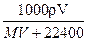
B.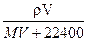
C.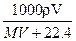
D.
参考答案:A
本题解析:略
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数,下列说法正确的是
A.常温常压下,4.4g CO2和4.4g N2O的原子总数都是0.3NA
B.次氯酸光照分解产生22.4mL气体(标准状况下),转移电子数为0.002NA
C.常温下,4.6g乙醇含有C—H键总数为0.6 NA
D.0.2 mol·L-1 FeCl3溶液中含有Cl-总数为0.6NA
参考答案:A
本题解析:由于二氧化碳和一氧化二氮的相对分子质量都是44,n=m/M,则n(CO2)=0.1mol,n(N2O)=0.1mol,由于1个二氧化碳分子含有3个原子、1个一氧化二氮分子含有3个原子,则0.1mol二氧化碳分子含有0.3mol原子、0.1mol一氧化二氮分子含有0.3mol原子,故A选项正确;根据次氯酸的性质及化合价升降总数等于转移电子数可得:2HClO 2HCl+O2↑~4e—,由于n=V/22.4L?mol—1,则n(O2)=0.001mol,转移电子与氧气的系数之比等于物质的量之比,则每产生0.001mol氧气,次氯酸分解反应转移0.004mol电子,故B选项错误;由于乙醇的相对分子质量为46,n=m/M,则n(C2H5OH)=0.1mol,由于1个乙醇分子中含有5个C—H键、1个C—C键、1个O—H键,则0.1mol乙醇含有0.5molC—H键,故C选项错误;由于溶液的体积未知,不能根据c?V求出氯化铁的物质的量,也不能求氯离子的物质的量,故D选项错误。
2HCl+O2↑~4e—,由于n=V/22.4L?mol—1,则n(O2)=0.001mol,转移电子与氧气的系数之比等于物质的量之比,则每产生0.001mol氧气,次氯酸分解反应转移0.004mol电子,故B选项错误;由于乙醇的相对分子质量为46,n=m/M,则n(C2H5OH)=0.1mol,由于1个乙醇分子中含有5个C—H键、1个C—C键、1个O—H键,则0.1mol乙醇含有0.5molC—H键,故C选项错误;由于溶液的体积未知,不能根据c?V求出氯化铁的物质的量,也不能求氯离子的物质的量,故D选项错误。
本题难度:一般
4、计算题 标准状况下,用一定量的水吸收氨气后制得浓度为12.0mol/L、密度为0.915 g·cm-3的氨水。试计算1 体积水吸收多少体积的氨气可制得上述氨水。(本题中氨的相对分子质量以17.0,水的密度以1.00 g·cm-3计)
参考答案:378
本题解析:
本题难度:一般
5、计算题 现有硫酸和硫酸钠的混合溶液200mL。其中硫酸的浓度为1mol/L,硫酸钠为0.5mol/L。若使硫酸和硫酸钠在混合溶液中的浓度分别为2mol/L和0.2mol/L,应加入55.8%的硫酸溶液(密度为1.38g/cm3)多少毫升?然后加水稀释到多少毫升?
参考答案:1.08L;0.02L
本题解析:
本题难度:一般