时间:2020-07-07 23:51:02
1、选择题 有人建议有AG来表示溶液的酸度,AG的定义为AG=lg[c(H+)/c(OH-)]。则下列表述正确的是(?)
A.在25℃时,若溶液呈中性,则pH=7,AG=1
B.在25℃时,若溶液呈酸性,则pH〈7 AG〈0
C.在25℃时,若溶液呈碱性,则pH〉7 AG〉0
D.在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH)
参考答案:D
本题解析:在25℃时,若溶液呈中性,则pH=7,c(H+)=c(OH-),所以AG=0,A不正确;在25℃时,若溶液呈酸性,则pH〈7,c(H+)>c(OH-),所以AG>0,B不正确;在25℃时,若溶液呈碱性,则pH〉7,c(H+)<c(OH-),所以AG<0,C不正确,因此正确的答案选D。
点评:该题是中等难度的试题,试题基础性强,难易适中。注重对学生灵活运用基础知识解决实际问题的能力。该题的关键是明确溶液中水的离子积常数与氢离子浓度之间的换算关系,有利于培养学生的逻辑推理能力和自学能力,以及知识的迁移能力。
本题难度:简单
2、选择题 PH=4的醋酸和氯化铵溶液中,水的电离程度的关系前者与后者比较(?)
A.大于
B.小于
C.等于
D.无法确定
参考答案:B
本题解析:醋酸是弱酸,抑制水的电离。氯化铵溶于水水解促进水的电离,答案选B。
点评:该是基础性试题的考查,难度不大。该题的关键是明确水的电离平衡特点,以及外界条件是如何影响水的电离平衡的。
本题难度:简单
3、选择题 25 ℃时,水中存在电离平衡:H2O H++OH-,下列关于水的说法,不正确的是( )
H++OH-,下列关于水的说法,不正确的是( )
A.水的电离是吸热过程
B.向水中加入少量稀硫酸,c(H+)增大,KW不变
C.含H+的溶液显酸性,含OH-的溶液显碱性
D.水是极弱的电解质,在50 ℃时水的pH小于7
参考答案:C
本题解析:弱电解质的电离是吸热过程,A项正确;B项中根据勒夏特列原理,c(H+)增大,KW只与温度有关,B项正确;溶液的酸碱性与c(H+)和c(OH-)的相对大小有关,而不是单一的只看c(H+)或c(OH-)大小,C项错误;升高温度,促进水的电离,c(H+)增大,pH减小,D项正确。
本题难度:一般
4、选择题 热化学方程式C(s)+H2O(g) CO(g)+H2(g);△H =+131.3kJ/mol表示( )
CO(g)+H2(g);△H =+131.3kJ/mol表示( )
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
参考答案:C
本题解析:依据反应热的概念,表示按照方程式系数的物质的量反应时吸收或放出的热量,单位是kJ·mol-1,该方程式表示:1mol碳和1mol水蒸气反应生成1mol一氧化碳气体和1mol氢气,并吸收131.3kJ的热量。特别要指明水的状态。
本题难度:简单
5、选择题
A.K>KW
B.K=KW
C.K<KW
D.无法比较
参考答案:A
本题解析:将纯硫酸类比于水找出纯硫酸的电离平衡是解此题的关键。
类比于水,纯硫酸的电离平衡可定为:H2SO4+H2SO4 H3SO
H3SO +HSO
+HSO
则其离子积常数KW=c(H3SO )·c(HSO
)·c(HSO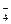 )。根据题意,纯硫酸的导电性强于水,则可粗略地认为硫酸中离子浓度大于纯水中离子的浓度,即K>KW。
)。根据题意,纯硫酸的导电性强于水,则可粗略地认为硫酸中离子浓度大于纯水中离子的浓度,即K>KW。
本题难度:简单