时间:2020-07-07 23:39:39
1、填空题 
(1) 已知:450℃时NH3的浓度大于550℃时,则正反应是______? __热反应;
(2) 反应进程中:0~2s内N2的物质的量由2mol变为1mol,则υ(H2)=___________;
(3) 能说明该反应已经达到平衡状态的是_________?__;
A.c(N2)=c(H2)="c" (NH3)? B.容器内压强保持不变?
C.υ(N2)=3υ(H2)? D.容器内的密度保持不变
(4) 可使该反应的反应速率增大,且平衡向正反应方向移动的措施是__________。
A.及时分离出NH3气体? B.适当升高温度
C. 增大压强? D.选择高效的催化剂
参考答案:(1)放热(1分) (2)0.75mol/(L·s) (2分) (3)B (1分) (4)C(1分)
本题解析:本题考查化学反应速率及化学平衡有关知识,关键在于明确化学反应速率的影响因素及化学平衡的判断。(1)450℃时NH3的浓度大于550℃时,说明温度升高,平衡向逆反应方向移动,则正反应是放热反应;(2)υ(H2)=3υ(N2)=3(2-1)/(2×2)= 0.75mol/(L·s);(3) A中浓度相等,但不一定达到平衡,只有浓度不在改变时,表示达到了平衡,该反应是体积不相等的反应,体积固定,故压强不变,表示该反应已达平衡;C项中未指明是正反应速率还是逆反应速率,故不能表示该反应已达平衡;体积固定,质量不变,密度不变,故不能表示该反应已达平衡;故选B。
(4)及时分离出NH3气体,减少生成物,减小逆反应速率,A不合题意;适当升高温度,平衡向逆反应方向移动,B不合题意;增大压强,反应速率增大,平衡向正反应方向移动,C合题意,正确;催化剂只改变反应速率,不影响平衡移动,D不合题意,故选C。
本题难度:一般
2、选择题 有关化工生产原理说法正确的是( )
A.工业上制粗硅:SiO2 + C Si + CO2↑
Si + CO2↑
B.海水提镁的主要步骤为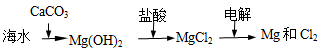
C.海水提溴原理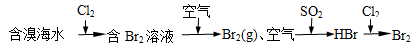
D.硫酸工业的接触室、合成氨工业的合成塔和氯碱工业的电解槽都有热交换器
参考答案:C
本题解析:
正确答案:C
A、SiO2+C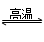 2CO↑+Si
2CO↑+Si
B 电解MgCl2的水溶液得不到Mg,应电解无水MgCl2
C 正确
D、氯碱工业的电解槽没有热交换器
本题难度:简单
3、选择题 “绿色化学”提倡化工生产应尽可能将反应物的原子全部利用,从根本上解决环境污染问题。在下列制备环氧乙烷的反应中,最符合“绿色化学”思想的是
[? ]
A.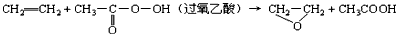
B.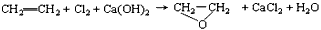
C.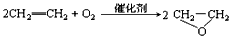
D.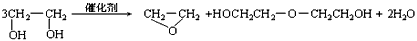
参考答案:C
本题解析:
本题难度:简单
4、填空题 (14分)?硫酸是工业生产中一种重要的化工产品,我国工业生产硫酸的主要方法是接触法,主要原料为黄铁矿,请回答下列问题:
(1)已知煅烧黄铁矿的化学方程式为?4FeS2 + 11O2
该反应中氧化剂和氧化产物之比为?;标准状态下得到4.48升SO2 时,一共转移了?mol e-。(每空3分)
(2)已知温度、压强对SO2平衡转化率的影响如下表所示:根据上表回答,SO2转化到SO3的
最佳反应条件是?。(每空2分)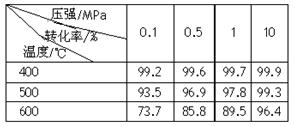
A.400-500℃ 0.1 MPa
B.400℃10 MPa
C.500℃10 MPa
D.400-500℃1 MPa
(3)在一定条件下,1mol SO2完全转化成SO3气体时放出热量为Q1 KJ,写出该反应的热化学方程式:?。若在该条件下将2 mol SO2放入一定容积的密闭容器中,一段时间后测得反应放出热量为Q2 KJ,则此时SO2的转化率为??(用含Q1、Q2代数式表示)。(每空2分)
(4)市售浓硫酸的密度是1.84 g / cm3、质量分数为98 % ,若用H2SO4· XH2O来表示这种浓硫酸,则X为??。(每空2分)
参考答案:(14分)
(1)11:10? 1.1? mol e-。(每空3分)?(2)B(2分)
(3)SO2(g)+1/2O2(g) ="=?"  ?SO3(g)?△H="-QKJ/mol?" Q2/2Q1?。(每空2分)
?SO3(g)?△H="-QKJ/mol?" Q2/2Q1?。(每空2分)
(4)1/ 9?。(每空2分)
本题解析:略
本题难度:一般
5、填空题 物质净化对生产生活很重要的意义。
(1)除去水中的 Ca2+,Mg2+等阳离子,完成此目标可使用____(填材料名称)。
(2)催化还原法可以净化硝酸工业尾气,下列物质中不能用于除去尾气中氮氧化物的是________(填字母序号)。
A.NH3
B.CH4
C.CO2
D.H2
(3)接触法制硫酸的工艺中,沸腾炉产生的炉气必须经过净化,除去其中的粉尘和______,净化后的炉气进入_____(填设备名称)。
(4)煤的气化技术的主要产物是______,将煤加热以得到焦炉气、煤焦油及焦炭等产品的技术称为___________ 。
参考答案:(1)阳离子交换树脂
(2)C
(3)水蒸气?转化器
(4)CO,H2;煤的干馏
本题解析:(1)使用阳离子交换树脂,除去水中的Ca2+、Mg2+离子;
(2)该气体具有还原性,排除CO2;选C。
(3)沸腾炉产生的炉气需要净化,除去其中的粉尘、水蒸气,再进入转化器。
(4)煤的气化是在高温下发生,C+H2O CO+H2;煤的干馏得到焦炉气、煤焦油、焦炭等。
CO+H2;煤的干馏得到焦炉气、煤焦油、焦炭等。
本题难度:一般